
Одна из причин старения
С возрастом белки в клетке начинают плохо сворачиваться из–за изменений в окислительно–восстановительном потенциале в местах сборки белковых молекул.
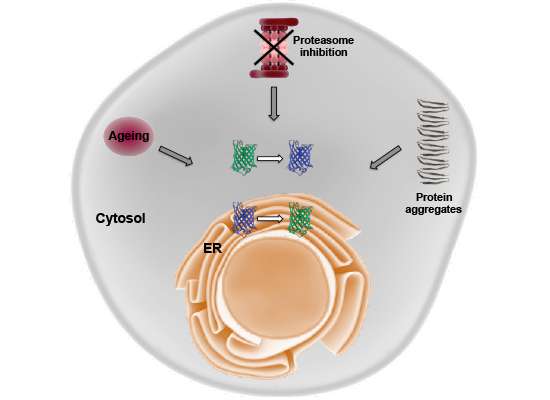
Методом генетически кодируемых сенсоров показано, что окислительно-восстановительное равновесие смещается в цитозоле клетки и протеостазис (процесс сворачивания молекулы белка) нарушается.
Старение тела начинается со старения его клеток, а с чего начинается старение клеток? Медики и биологи до сих ещё не знают всех причин, хотя многие читатели наверняка вспомнят о самых известных теориях старения, в которых говорится про теломеры и митохондрии.
С одной стороны, известно, что теломерные участки, защищающие концы хромосом, укорачиваются с каждым делением, так что клетка может беспрепятственно делиться некоторое ограниченное число раз, после чего у неё начнут повреждаться важные гены, примыкающие к оголённым хромосомным концам. И процессы старения связывают отчасти с укорочением теломер. С другой стороны, клеточные митохондрии, хотя и обеспечивают нас энергией, в качестве побочного эффекта служат неиссякаемым источником агрессивных молекул–окислителей – кислородных радикалов, повреждающих белки, ДНК, липиды мембран и другие биомолекулы. Обычно клетке есть что противопоставить окислительному стрессу, но со временем антиоксидантные механизмы слабеют (отдельный вопрос, конечно, почему они слабеют), и окислительный стресс становится всё сильнее, на уровне организма становясь причиной возрастных заболеваний.
Однако, как мы знаем, в живой материи всё взаимосвязано, и было бы странно, если бы процессы старения зарождались обособленных участках клетки, не затрагивая другие её отделы. Как показали эксперименты Янины Кирштайн (Janine Kirstein) из Лейбницевского института молекулярной фармакологии и её коллег из Японии и США, одним из самых мощных «источников старения», если можно так сказать, служит эндоплазматический ретикулум, или эндоплазматическая сеть (ЭР, или ЭС). Он (или она) представляют собой сложную разветвлённую сеть мембранных каналов, цистерн и пузырьков, и в школьных учебниках биологии говорится, что на мембранах эндоплазматической сети, обсаженных рибосомами, идёт синтез белковых молекул и сворачивание готовых белковых молекул в правильную пространственную конформацию.
Аминокислоты, входящие в состав белковой молекулы, взаимодействуют друг с другом и с окружающим раствором, некоторые притягиваются, некоторые отталкиваются, в результате полипептидная цепочка приобретает так называемую третичную структуру – сворачивается в чрезвычайно сложно устроенный клубок. Именно в таком виде белок, будь то фермент, белок–транспортёр и т. д., может выполнять свою функцию (например, активный центр ферментов, в которых происходит расщепление субстратных молекул или сшивание их вместе, формируется как раз в результате пространственного сворачивания аминокислотной цепочки).
Одна из наиболее известных «скрепок», помогающая белку держатся в свёрнутом состоянии – ковалентная связь между атомами серы, входящими в состав аминокислоты цистеина. Образующиеся дисульфидные мостики могут сближать довольно удалённые участки полипептидной цепи; и такие связи необходимы для функционирования самых разных белков, в том числе инсулина и антител.
Дисульфидные сшивки образуются в эндоплазматической сети, в которой есть необходимые физико–химические условия. Окислительно–восстановительный потенциал (не путать с кислотностью!) в системе мембранных каналов и цистерн сдвинут в окислительную сторону, так что атомы серы из цистеинов легко могут образовать между собой ковалентную связь. Но, как пишут авторы работы в , со временем окислительно–восстановительный потенциал в эндоплазматической сети теряет окислительные способности, из–за чего белки перестают сворачиваться и работать, как надо.
Это объясняет очень многое: известно, например, что с возрастом появляется всё больше неправильно свёрнутых белковых молекул, что многие секреторные белки становятся нестабильны и перестают функционировать при малейшем стрессе; даже возрастное ослабление иммунитета можно объяснить смещением окислительно–восстановительного потенциала, поскольку антитела перед выходом из клетки не могут зафиксировать нужную пространственную структуру. (В то же время в окружающей цитоплазме всё происходит наоборот: окислительный потенциал среды растёт и усиливается пресловутый окислительный стресс, из–за которого портятся белки.)
Непорядки в работе эндоплазматической сети могут случаться и при стрессе и приводить к тем же последствиям – накоплению неправильно свёрнутых молекул белка. Здесь стоит вспомнить, что нейродегенеративные болезни, такие, как синдром Альцгеймера, синдром Паркинсона, синдром Хантингтона, возникают как раз по вине белков с неправильной пространственной структурой. И здесь тоже, по словам исследователей, всё начинается с проблем в окислительно–восстановительном потенциале эндоплазматической сети. Более того, как оказалось, патогенные молекулы белков, появившись в одних тканях, могут вызывать изменения в окислительно–восстановительном потенциале других тканей, ускоряя тем самым процессы старения.
В молекулярной и клеточной биологии на самом деле довольно давно существует понятие ЭР–стресса (стресса, связанного с эндоплазматическим ретикулумом), когда в клетке вдруг начинают активно накапливаться белки с неправильной укладкой. Новые эксперименты позволили связать ЭР — стресс с процессами старения и с физико–химическими неполадками в важнейшем клеточном органоиде. Опыты ставили на червях–нематодах, которых модифицировали таким образом, чтобы можно было следить за изменениями окислительно–восстановительного потенциала в разных участках клеток. Впрочем, учитывая, что синтез белка и его сворачивание происходят у всех организмов, есть все основания полагать, что возрастные изменения в эндоплазматической сети имеют место и у человека.
Конечно, всё это только усложняет картину старения, но, с другой стороны, в биологии вообще почти никогда не бывает «одной главной причины» чего бы то ни было, всегда приходится рассматривать целый пучок причин и следствий. И чем больше мы будем здесь знать, тем точнее сможем определять динамику и стадию старения, а там, глядишь, и до вечной молодости как–нибудь доберёмся.
Первоисточник
|
 http://www.scorcher.ru/xml/news.rss
http://www.scorcher.ru/xml/news.rss