Пирназарова Ф.Н. Динамический баланс энтропийных и информационных процессов в сопряжённых биосистемах
Относится к разделу Биология
Пирназарова Ф.Н. Динамический баланс энтропийных и информационных процессовв сопряжённых биосистемах
Аннотация
Основная задача исследования состояла в изучении кинетики одновременно двух противоположно-направленных процессов - свободно-радикальных и антиокислительных - в различных по устойчивости растениях хлопчатника Gossipiumhirsutumпри инфицировании отличающимися по вирулентности нагрузками рас гриба VerticilliumdahliaeKlebahn.Результаты экспериментов показали, что уровень антиокислительной активности липид-пигментных комплексов (АОА) в образцах замороженных листьях хлопчатника изменяется в кинетике последействия паразита антибатно кинетике радикальных процессов. Пульсирующая концентрация парамагнитных комплексов ионов Мn+2 в зелёных листьях хлопчатника синхронно связана с концентрацией активных промежуточных радикалов - семипластохинонов, регистрируемых на спектрометре ЭПР при g = 2,00 и t= -100±10С. Было показано, что текущая концентрация ПК Мn+2 становится сигнальной, характеризуя интенсивность окислительных и радикальных, т.е. энтропийных процессов – Redox-signaling. Кинетика изменения содержания антиоксидантов в контрольных и опытных образцах листьев характеризует направленность антиэнтропийных информационных процессов.
Тогда качественной специфичностью биологической формы движения является динамическое равновесие противоположно-направленных процессов – энтропийных и информационных, развитие структурной компартментализации этих двух противоположных функций, реактивности и чувствительности мембранных структур живой клетки - целостной биологической системы.
Ключевые слова:растения хлопчатника, вертициллёзный гриб, радикалы, антиокислительная активность,энтропийные процессы, антиэнтропийные, информационные процессы, реактивность, устойчивость, надёжность.
ВВЕДЕНИЕ
По современным данным Земля образовалась 4-4,5 млрд лет назад, возраст земной коры составляет около 3,9 млрд лет, а жизнь на Земле возникла около 3,8 млрд лет назад[1]. «Складывается впечатление, - пишет Н.Н.Воронцов,- что буквально сразу после остывания земной коры на нашей планете возникла жизнь. Как будто-бы к планете стоило поднести спичку, чтобы на ней вспыхнуло пламя жизни!» [2]. Важно, что жизнь сразу же должна была существовать в виде экосистем. Неизбежное возрастание биоразнообразия должно было вести к увеличению устойчивости таких экосистем, быстрому росту их продуктивности и биомассы на планете. Раз возникнув, жизнь должна была (в геологическом масштабе времени - мгновенно) охватить всю планету.
К числу древнейших экосистем относятся растительно-грибные экосистемы. 400-500 млн лет назад предки высших растений, возможно, уже в водной среде вступали в симбиозы с различными водными грибами, как это делают сегодня зеленые и красные водоросли [3]. Сегодня крупнейшие эволюционисты и микробиологи не могут себе представить самые первые шаги в эволюции жизни иначе, как последовательные кооперации и симбиозы разных химических и геохимических циклов между собой. Это можно назвать химическим этапом эволюции. Сейчас ясно, что без кооперации, без взаимодействия эволюция начаться бы не могла [4].
Достижения паразитологии, демэкологии и теории эволюции ярко демонстрируют фактическую облигатность явления симбиоза для существования и эволюции биологических видов. Под симбиозом в данном случае понимаются отношения, традиционно трактуемые как паразитизм, мутуализм, комменсализм и др., складывающиеся между видом-хозяином и его сожителями — видами-симбионтами. В результате симбиогенеза возникают и эволюционно длительно развиваются новые биосистемы субклеточного, клеточного, органного, организменного и надорганизменного (в частности, популяционного) уровней
Pазвитие разнообразных растительно-грибных и растительно-бактериальных симбиозов представляет собой единый эволюционный континуум. Разнообразие, симбиоз, разделение функций и информационный обмен — изначальные свойства земной жизни. Симбиоз – не просто очень широко распространенное явление. Это магистральный путь эволюции, без которого прогрессивное развитие жизни на Земле было бы крайне затруднено, если вообще возможно [5]. Все большее распространение получают научно обоснованные взгляды, согласно которым человек как “суперорганизм” издревле составлял и составляет морфофункциональное единство со своей микрофлорой (прежде всего кишечной) [6].
Можно предполагать, что экологические взаимоотношения растений и патогенов претерпели сложную коэволюцию на молекулярном уровне: растения в процессе эволюции вырабатывали все более активные постингибитины, фитоалексины, PR-белки и пептиды, а также способность к сверхчувствительной диагностике начала инфекции, а патогены — все более эффективные биохимические механизмы противостояния указанным защитным соединениям растений.
Эволюция взаимоотношений фитопатогенных грибов и растений-хозяев привела к тому, что высокоспециализи-рованные биотрофные (прижизненные) грибы-эндобионты существуют за счет обусловливаемых ими модификаций цитоплазматической мембраны клеток растения-хозяина в отношении транспорта метаболитов и биосинтеза клеточной
стенки. При этом обеспечиваются высокоуравновешенные взаимоотношения грибов и растений-хозяев. Cогласно концепции Савинова [6], единицей организменного уровня является не особь (индивидуум), а аутоценоз, т.е. самоуправляемая система хозяин-симбионты с прямыми и обратными связями. Аутоценоз представляет собой типичный симбиоз, характеризующийся: 1)совокупностью общих для хозяина и симбионтов коэволюционно сформированных и скоординированных метаболических процессов; 2) взаимной генной (сигнальной) регуляцией и нередко взаимными изменениями организации генов и геномов; 3) коэволюцией в направлении усиления функционально-структурной интегрированности и взаимозависимости партнеров.
В 1990 г. в итоговой работе по определению физико-химических критериев и факторов сопряжённой эволюции авторы приходят к заключению: «Физико-химические исследования динамической системы растение-хозяин - паразит позволили выдвинуть постулат o наличии динамического равновесия двух ассиметричных функций в мембране и клетке, предложить двухкомпартментальную модель мембранных и клеточных процессов» [7]. В настоящей работе предпринята попытка переосмысления результатов исследований свободно-радикальных и антиокислительных процессов на примере взаимоотношений в системе растение-хозяин – патоген,выполненных в течение последних 30 лет – уже с позиций оценки роли энтропийных и антиэнтроптйных, информационных процессов в коэволюции сопряжённых биосистем.
1. Исследования свободно-радикальных процессов в растениях хлопчатника
Свободные радикалы (СР) - это неустойчивые высокореактивные атомы или молекулы, которые имеют неспаренный электрон на внешней орбите. Все активно метаболизирующие клетки растений и животных содержат свободные радикалы в концентрации 10-6—10-8 молей на 1 г ткани [8]. Радикалы обладают высокой реакционной способностью, и их стационарная концентрация в клетках всегда очень мала.
Наличие в структуре радикалов неспаренного электрона на внешней оболочке атома или молекулы обуславливает их нестабильность и высокую реакционную способность (табл.1). Радикал гидроксила известен как один из самых мощных окисляющих агентов. Одна наносекунда времени полужизни радикала гидроксила соответствует его чрезвычайно высокой реактивности [9].
Табл. 1
Свободные радикалы – время полураспада при 370С [9].
Radical | Symbol | Half-Life Time |
Hydroxyl | .OH | one nanosecond |
Singlet Oxygen | 1O2 | one microsecond |
Superoxide | .O2− | one microsecond |
Alkoxyl | .OL | one microsecond |
Peroxyl | LOO. | ten milliseconds |
Nitric Oxide | .NO | few seconds |
Одной из причин нарушения физиологических процессов у растений при действии повреждающих абиотических (хаотропных) факторов является интенсивная генерация активных форм кислорода (АФК). Для активных форм предложена формула: Активные формы = свободные радикалы + реактивные молекулы [10].
К активным формам кислорода (АФК) относятся супероксид, радикал гидроксила, перекись водорода и синглетный кислород. Известно, что АФК вероятно играют ключевую роль в активации фиброцитов, «активные метаболиты кислорода действуют как специфические промежуточные передаточные вещества для ряда биологических процессов, включая воспаление, фиброз и, возможно, нейротрансмиссию» [10].
Основным предшественником активных форм кислорода (АФК) является анион-радикал супероксида. Открытие супероксиддисмутазы (СОД) совершило революцию в умах биохимиков: раз есть фермент, нейтрализующий свободные радикалы, специально вырабатываемый живыми клетками (и, как выяснилось, чрезвычайно широко распространённый в живой природе), то ясно, что и сами радикалы являются активными участниками метаболизма клеток. До этого мало кто думал, что в метаболизме живых организмов участвуют не только целые молекулы, но и свободные радикалы [10].
О ведущей роли радикалов в механизмах цепных реакций, особенно горения и взрыва, впервые заявил акад. Н. Н. Семёнов, будущий Нобелевский лауреат и создатель Института химической физики АН СССР, который свою первую значительную монографию «Цепные реакции», изданную в 1934 г., посвятил памяти создателей физической химии и химической кинетики Сванте Аррениуса и Якоба Вант Гоффа [11]. Ученики акад.Семёнова – в ИХФ и МГУ – продолжили изучение свободных радикалов в биологии. Так, акад. Эмануэль Н.М. создал свою школу, показал перспективность использования представлений и методов химической кинетики для изучения многих биологических процессов. Сотрудниками Отдела кинетики химических и биологических процессов ИХФ АН СССР (в настоящее время преобразован в Институт биохимической физики им. акад. Н. М. Эмануэля) в 60-70 гг. проводились широкие исследования свободных радикалов и антиоксидантов в замороженных образцах животных и растений в динамике опухолевых заболеваний (Круглякова К. Е., Бурлакова Е. Б., Ванин А. Ф., Стригун Л.М., Саприн А. Н., Чибрикин В.М., Долягин А.Б. и др.) Исследователями Института химической физики АН СССР уделялось большое внимание роли радикалов в механизмах патогенеза растений и животных [12-14]. Все эти исследования явились громадным опытом для выбора наиболее прямого пути к будущим широким обобщениям. Лекции, семинары, конференции, школы ЭПР под предводительством неподражаемого и обаятельного проф. Льва Александровича Блюменфельда, - всё это воспламеняло воображение и вдохновляло молодых учёных на поиски своего пути для познания ИСТИНЫ.
В Узбекистане всегда существовала проблема поиска надёжных и эффективных мер борьбы с вертициллёзным вилтом ведущей с/х культуры – хлопчатника. Несмотря на многочисленные исследования, посвящённые проблеме вилтоустойчивости хлопчатника, изучение механизмов взаимодействия растения-хозяина и гриба-паразита остаётся чрезвычайно актуальным. Изучение свободно-радикальных состояний в вегетирующих листьях хлопчатника явилось первым шагом на пути исследования интимных механизмов мембранных процессов.
Изучение спектров ЭПР листовой ткани хлопчатника, как и для всех фотосинтезирующих тканей растений, при низкой температуре (173К) показало наличие двух типов сигналов (рис.1): I) сигнал СР семихинонной природы, характеризующийся полушириной DН = 15-20 э, с g-фактором, близким к g-фактору свободного электрона (g ≈ 2,00); 2) сигнал парамагнитного иона Мn+2 с шестикомпонентной сверхтонкой структурой в диапазоне значений g-фактора =1,865-2,157. Величина расщепления между компонентами увеличивается с усилением магнитного поля от 80 до 96 э [12, 15-18].
Устойчивый парамагнитный ион Мn+2 имеет пять Зd-электронов с максимальным суммарным спином (5/2), которые обусловливают его регистрацию методом ЭПР. В понятие свободного радикала не включаются ионы металлов переменной валентности, неспаренные электроны в которых находятся на внутренних оболочках. Поскольку ионы таких металлов как железо, медь или марганец (так же как комплексы этих металлов) дают сигналы электронного парамагнитного резонанса (ЭПР), эти частицы в совокупности с белковым окружением называют парамагнитными комплексами (ПК) [19].
Большинство металлсодержащих электронных переносчиков при комнатных температурах дают настолько широкие сигналы, что они становятся практически невидимыми. Для наблюдения сигналов ЭПР от этих переносчиков необходимо ослабить спин-решеточное взаимодействие снижением температуры регистрации сигнала. В условиях термостатированного измерения сигналов ЭПР (в парах жидкого азота при t = - 1000C) чётко регистрируются сигналы ПК Мn+2; не фиксировались сигналы ПК железа (Fe2+ - в цитохромах, фередоксине), меди (Cu2+ - в пластоцианине), т.к. для регистрации этих ПК пришлось бы понизить температуру измерения спектров ЭПР вплоть до 4-20К [19].
|
Рис.1. Спектр ЭПР образца листьев хлопчатника (1730К) |
Нами была исследована кинетика изменений свободнорадикальных состояний (СРС) в листьях различных по вилтоустойчивости сортов хлопчатника на протяжении трех недель после инфицирования грибом Verticcillium dahliae Kleb. [20]. Было обнаружено, что активная реакция на заражение сопровождается усилением свободнорадикальных окислительных процессов (СРОП) на ранних этапах заражения патогеном (1-я неделя после инфицирования). Спектры ЭПР листовой ткани зараженных грибом растений хлопчатника в качественном отношении не отличались от таковых здоровых растений; отличие их состояло в разной интенсивности сигналов СР и ПК Мn+2.
Динамика окислительных процессов, так же как и антиокислительных, имеет во времени колебательный характер, зависящий от суточных, сезонных и других биоритмов. Биоритмологические исследования радикальных процессов в животных тканях показали их чрезвычайную лабильность в зависимости от факторов среды и времени взятия пробы [14].
|
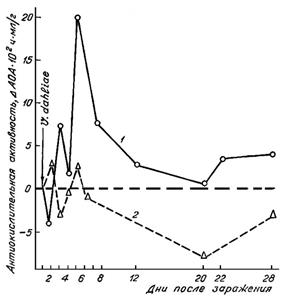
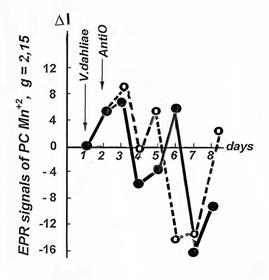
Рис. 2. Динамика изменения концентраций свободных радикалов семихинонного типа (g=2,00) и парамагнитных комплексов Mn++ (g=2,157) в норме (1) и при инфици-ровании (2) грибом Verticilliumdahliae растений хлопчатника сорта 108-Ф (а) и mexicanumvar. nervosum |
Изучение динамики взаимодействия растения с фитопатогеном при фотопериодической регуляции устойчивости путем изменения темпов ростовых процессов, следовательно, и цикла развития, дало более полную картину [17, 20]
Динамика изменений СРС носила одинаковый характер для свободных радикалов семихинонного типа (g=2,00), так и для парамагнитных ионов двухвалентного марганца (Mn+2) (рис.2.)
Поскольку удлинением цикла развития растений хлопчатника Goss. hirsutum можно повышать устойчивость, и наоборот, сокращая его - усиливать восприимчивость, мы исследовали динамику изменений концентрации СР и ПК Мn+2 в листьях различающихся по вилтоустойчивости растений хлопчатника (108-Ф и разновидность mexicanum nervosum), выращенных при различном световом режиме. Исследование свободнорадикальных окислительных процессов (СРОП) в листьях хлопчатника изученных сортов показало различную картину на протяжении первых трех недель после инфицирования патогеном (рис.3). Отличительным признаком реакции устойчивости является ответное повышение интенсивности СРОП на 7-й день после заражения, сменяющееся снижением до уровня контроля в активной фазе заболевания (14-й день). Для реакции восприимчивости наблюдается противоположная картина (рис.3 а - естественный день).
В условиях короткого светового дня вследствие сокращения цикла развития и раннего перехода к генеративной фазе, растения обеих форм поражаются сильнее, чем в условиях естественного дня. В этих условиях изменения интенсивности СРОП в обоих вариантах показали реакцию, характерную для реакции восприимчивости на 7- и 14-й дни после инфицирования (рис. 3).
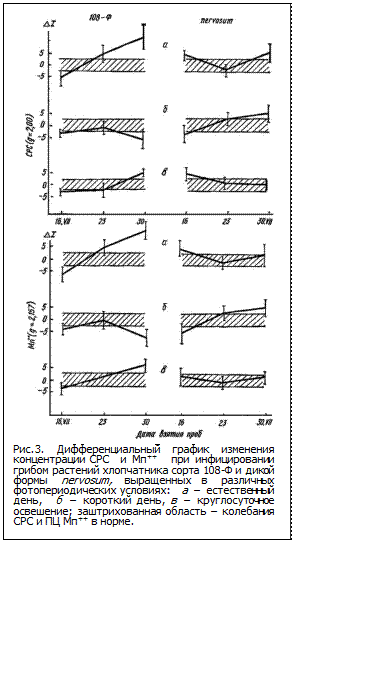 При режиме круглосуточного освещения вследствие преобладания ростовых процессов над развитием, образуются мощные растения с крупной листовой пластинкой. В этих условиях растения обеих форм не поражаются в сильной степени (рис.3); по интенсивности СРОП растения обеих форм при заражении показали ответную реакцию, характерную для реакции устойчивости (рис.3).
При режиме круглосуточного освещения вследствие преобладания ростовых процессов над развитием, образуются мощные растения с крупной листовой пластинкой. В этих условиях растения обеих форм не поражаются в сильной степени (рис.3); по интенсивности СРОП растения обеих форм при заражении показали ответную реакцию, характерную для реакции устойчивости (рис.3).
Наблюдаемое повышение интенсивности СРОП на 21-й день после инфицирования в условиях естественного дня у восприимчивого сорта 108-Ф обусловлено, по всей вероятности, вкладом в патологический процесс вертициллёзного гриба, который к этому времени уже достаточно широко заселяет и развивается в растении [20].
Различный тип ответной реакции у различающихся по степени устойчивости растений хлопчатника коррелирует с поражаемостью вилтом в этих условиях (рис.4).
Таким образом, исследование динамики изменений интенсивности СРОП в устойчивых растениях хлопчатника (разновидности nervosum) показало, что активная реакция на заражение сопровождается повышением уровня СРС на начальной стадии (1-ая неделя после заражения). Динамика изменений свободнорадикальных состояний носила одинаковый характер как для СР семихинонного типа, так и для ПК Мn+2.
|
Рис.4. Поражаемость хлопчатника вилтом в различных фотопериодических условиях |
Слабые колебания уровня СРС у устойчивой формы при естественной длине дня и круглосуточном освещении свидетельствуют о стабильности метаболизма, о неспособности паразита нарушить энергетику и нормальный обмен веществ. Внедрение же патогена в ткани неустойчивого сорта обусловило колебания СРС в зависимости от условий фотопериодизма. Резкий спад СРС в III срок отбора в варианте с коротким днем обусловлен крайней степенью угнетения жизнедеятельности растений. Меньшая степень заболеваемости хлопчатника при круглосуточном освещении коррелирует с возрастанием СРС. В связи с этим можно считать, что выражением активной борьбы растительного организма против патогена является повышение концентрации свободнорадикальных состояний.
Эти данные согласуются с изменениями дыхательной активности тканей, инфицированных полусапрофитными и облигатными паразитами. У иммунных форм хлопчатника активирование дыхания тканей при заражении грибом сопровождается повышением активности полифенолоксидазы и пероксидазы, усилением интенсивности окислительного фосфорилирования, о чем свидетельствует увеличение коэффициента Р/О митохондрий [17].
Симбатность кинетик сигналов СР и ПК Мn+2 свидетельствовала о наличии подвижного равновесия [Мn+2] ↔ [Мn+3] ↔ [Мn+4]; при этом относительное содержание восстановленного иона Мn+2 в общем марганцевом пуле растительной клетки пропорционально степени окисленности ближайшего липидного окружения. Следовательно, парамагнитный ион марганца, так же как семихинонные радикалы, может служить маркером интенсивности окислительного метаболизма. Поэтому для характеристики свободнорадикальных окислительных процессов (СРОП) в листовой ткани растений нами предложено использовать более чувствительный и надежный параметр — сигнал парамагнитных ионовМn+2 [21].
2. Парамагнитные ионы марганца как сигнальные маркеры – Redox-signaling.
Марганец поступает в растение в виде ионов Мп2+. Среднее содержание марганца в растениях 0,001 %. В растении марганец находится в разной степени окисления (Мп2+, Мп3+, Мп4+) и характеризуется высоким показателем окислительно-восстановительного потенциала. Уникальность марганца связана со значением этого микроэлемента в реакциях биологического окисления [22].
Специфической потребностью в марганце обладает огромное число ферментов. Так, например, ионы Мn+2 являются обязательным кофактором пероксидазных систем (оксидаза ИУК), в комплексе с АТФ участвует в ферментативных реакциях. Мn+2 необходим для нормального хода процесса фотосинтеза, поскольку входит в состав активного центра кислород-выделяющего комплекса фотосистемы II и осуществляет разложение воды и выделение кислорода. Было предположено, что в роли доноров выступает четверка ионов двухвалентного марганца. Каждый отдает по одному электрону фотосистеме ФС II, переходя в трехвалентное состояние. Потом они берут у двух молекул воды сразу четыре электрона. Если из фотосинтезирующей системы растения удалить марганец, фотосинтез прекращается — с добавкой же двухвалентного марганца он возобновляется [23-24].
"Комплекс марганца произвел весь кислород, от которого зависят сегодняшние формы жизни, – говорит Виттал Ячандра (Vittal Yachandra), возглавляющий в американской национальной лаборатории Беркли (Berkeley Lab) программу исследования уникального биологического механизма под названием "кислород-выделяющий комплекс" (oxygen-evolving complex – OEC). – Это изменило курс развития всей жизни" [24]. Учёный подразумевает, что два с половиной миллиарда лет назад бактерии, подобные современным цианобактериям, как-то научились разрушать воду на молекулы кислорода и водорода, и кислород впервые начал накапливаться в атмосфере. Предполагают, что первые на Земле растения, предки нынешних, возникли в результате симбиоза фотосинтезирующих бактерий и водорослей [24]. «СУММА ЖИЗНИ на земле – её создают, оберегают, хранят растения. Испокон веков каждодневно из неживого – воды, углекислого газа да солнечных лучей – ткут растения пищу и энергию для всего сущего» [25]. На тилакоидных мембранах хлоропластов закреплены огромные группы сложных белков. Таких групп две – "фотосистема I" и "фотосистема II" (PSI и PSII). А в недрах PSII находится комплекс – OEC, без которого фотосинтез был бы невозможен. «Жизнь на Земле держится всего на четырёх атомах марганца» - так озаглавлена статья, посвящённая исследованиям комплекса ОЕС с предполагаемой структурой – Mn4OnCa [24].
|
Рис.5 Предполагаемая схема фотохимического окисления воды до O2 с участием комплексов марганца в PS-II |
Удивительно. За прошедшие миллиарды лет жизнь претерпела сложнейшую эволюцию – только сердцевина процесса фотосинтеза осталась абсолютно неизменной – всего несколько актов из сложного танца ионов, фотонов и электронов – и проблема существования жизни на планете решена!
Возможный механизм фотохимического окисления воды до O2 с участием комплексов марганца в ФС-II фотосинтеза приводится в работе Рахимова Р.Х. (рис.5) [26, c.589].
Кислород-выделяющий комплекс – OEC - фотосистемы II генерирует кислород из воды, используя каталитический кластер Mn4OnCa (n зависит от механизма и природы интермедиатов). Согласно последним данным, структурное и электрохимическое сравнение между подразделениями [Mn3CaO4]6+ и Mn4O4 наряду с характеристикой промежуточногоCa-Mn мультиядерного комплекса отражает потенциальную роль кальция в содействии достижения высокоокисленных состояний марганца и в сборке биологического кластера [27].
Освещение хлоропластов приводит к появлению потока электронов, переносимых между различными компонентами цепи электронного транспорта - ЦЭТ. За счет энергии света по этой цепи происходит последовательный перенос электронов от воды, разлагаемой в ФС II, к молекуле NADP+ - конечному акцептору электрона, получающему электроны от фотосистемы ФС I. Таким образом, суммарный результат работы ФС II — это окисление 2 молекул воды с помощью 4 квантов света с образованием 4 протонов во внутритилакоидном пространстве и 2 восстановленных пластохинонов в мембране хлоропластов [24, 28, 29].
Учитывая вышеуказанные факты, стало возможным модифицировать известную Z-схему фотосинтеза [29] и дополнить её современными представлениями [30-31] на рис.6.
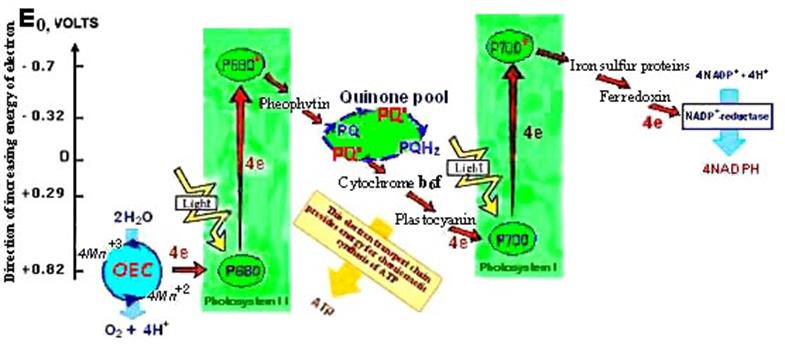
Рис. 6. Z-cхема фотохимических систем (ФС I и ФС II) .
Е0 — при pH 7 (в вольтах), ОЕС— кислород-выделяющий комплекс - для ФС II, P680 — энергетическая ловушка и реакционный центр ФС II, Р700 — энергетическая ловушка и реакционный центр ФСI, Феофитин — первичный акцептор в ФС II, NADPH – продукт конечной редокс-реакции.
Фотосистема II (или вода-пластохинон-оксидоредуктаза) – это первый белковый комплекс в свето-зависимых реакциях. Фермент использует фотоны света, чтобы энергизовать электроны так, что затем они переносятся через ряд коэнзимов и кофакторов, чтобы восстановить пластохиноны до пластохинолов с образованием семипластохинонных радикалов PQ· (в хинонном пуле – рис.6) [30-31]. В дыхательной цепи митохондрий важным звеном цепи переноса электрона служит убихинол (коэнзим Q). Радикал семиубихинона ·QH является кдючевым компонентом цикла убихинонного пула и при нарушении работы цепи может стать источником более токсичных радикалов кислорода (рис.7) [10]
|
Рис.7. Убихинонный пул в дыхательной цепи митохондрий. |
Исходя из Z-схемы работы систем фотосинтеза (рис.6) совершенно очевидна взаимосвязь и координация концентрации Mn+2 и семипластохинонных радикалов, находящихся в подвижном равновесии с окисленной формой (пластохинонами) и восстановленной формой (пластохинолами). Таким образом, активная концентрация парамагнитных комплексов Mn+2в фотосинтезирующих листьях растений может коррелировать с содержанием радикальных состояний семихинонного типа и в целом с Redox-системой, осуществляя Redox-signaling, что и подтвердили наши эксперименты с растениями хлопчатника [20-21].
Redox signaling – это процесс, где свободные радикалы, активные формы кислорода (АФК), и другие электронно-активированные формы действуют не только как сигнальные посланники, но и как непосредственные посредники в окислительно-восстановительных реакциях биологических систем [32]. Таким образом, текущая концентрация ПК Mn+2 в фотосинтезирующих листьях растений коррелирует с содержанием СР и в целом с Redox-системой, осуществляя Redox-signaling. Интенсивность сигнала ПК Mn+2 в замороженных в жидком азоте образцах растений (t≈ 4K) оказалась удобным инструментом слежения за кинетикой изменения концентрации СР в живой ткани растений [21]. Так как подвижное равновесие парамагнитных и диамагнитных форм комплексов марганца чутко реагирует на динамическое равновесие окислительных и антиоксидантных процессов в живых фотосинтезирующих листьях растений, тогда концентрация парамагнитных комплексов ионов Мn+2 в зелёных листьях растений может служить сигналом, характеризующим интенсивность окислительных и радикальных, т.е. энтропийных процессов – Redox-signaling.
3. Изучение СР и АОА процессов в листьях хлопчатника в динамике заражения вилтом.
Особый интерес вызвали исследования СРОП в непосредственной связи с изучением антиокислительной активности (АОА) растений при воздействии патогена – гриба вертициллёзного увядания V.daliae Kl. [21, 33].
|
Рис.8. Динамика изменений показателей СРС (А) и АОА ЛПК (Б) в листьях контрольных растений хлопчатника, разли-чающихся по устойчивости сортов: (●▬ ●) - устойчивый; (▲--▲) - восприимчивый.
|
Патогенные агенты вызывают нарушение нормального хода всех обменных процессов растения-хозяина. Многочисленными исследованиями показано, что в ходе патологических процессов происходит усиление свободно-радикального окисления липидов (в первую очередь мембранных) [10].
В несопрягающих мембранных структурах (внешние плазматические мембраны, мембраны эндоплазматической сети, аппарата Гольджи, лизосом и пероксисом, внешние мембраны хлоропластов и митохондрий) может идти свободное окисление через непосредственное включение кислорода в молекулы органических соединений. При этом наиболее восприимчивы к окислению молекулярным кислородом ненасыщенные липиды, в частности, полиненасыщенные жирнокислотные остатки фосфолипидов, образующие гидроперекиси и перекиси липидов. Ненасыщенные ацилы мембранных фосфолипидов в аэробных условиях легко окисляются по свободнорадикальному механизму под действием ферментативных и неферментативных систем (НАДФ-Н-зависимая микросомальная диоксигеназа, Fe+2 + аскорбат) с образованием короткоживущих перекисных радикалов и гидроперекисей, индуцирующих генерацию более стабильных радикалов семихинонного типа [34].
Свободнорадикальным окислительным процессам (СРОП) противодействует антиоксидантная система клетки, сочетающая ферментативную антиоксидантную защиту и пул биоантиоксидантных молекул, распределенных в мембранной и цитоплазматических фазах. Функционирование антиоксидантной системы предопределяет надежную защиту от избыточного окисления, а также антирадикальную и аитиперекисную защиту с детоксикацией продуктов свободнорадикального окисления.
![]() Биологический эффект антиоксидантов сводится к торможению свободнорадикального неферментативного окисления ненасыщенных жирных кислот липидов (НЖКЛ) и смещению конкурентного отношения свободнорадикального и ферментативного окисления в пользу последнего, регулируя тем самым направление большинства метаболических процессов [35]. От количества антиоксидантов, их физико-химических свойств, от взаимодействия их между собой и компонентами клетки, зависит антиокислительная активность (АОА) липидов. Информативным показателем является величина АОА липид-пигментного комплекса (ЛПК) растений, измеряемая методом ингибирования термического окисления модельной системы — метилолеата и отражающая действующую концентрацию липофильных антиоксидантов [21]. Фиксация образцов листьев в жидком азоте позволила повысить точность и надежность определения интенсивности как радикальных, так и антиокислительных процессов [20-21]. Как показано Бурлаковой Е.Б. с сотр.[36], изменение антиокислительной активности (АОА) суммарной липидной системы адекватно изменениям АОА липидов мембранных фрагментов субклеточных органелл. Величина АОА липид-пигментного комплекса (ЛПК) растений, измеряемая методом ингибирования термического окисления модельной системы — метилолеата, отражает действующую концентрацию липофильных антиоксидантов. Поэтому уровень липофильных антиоксидантов в ЛПК, выделенных из навески замороженных листьев, может служить показателем АОА липидов, сосредоточенных в мембранной системе зеленого листа в момент взятия пробы. Исследованиями Бурлаковой с сотр. [35] показана однотипность, неспецифичность и общность в изменении АОА при самых разнообразных воздействиях на организм - облучение, стресс, гипероксия, злокачественный рост и др.
Биологический эффект антиоксидантов сводится к торможению свободнорадикального неферментативного окисления ненасыщенных жирных кислот липидов (НЖКЛ) и смещению конкурентного отношения свободнорадикального и ферментативного окисления в пользу последнего, регулируя тем самым направление большинства метаболических процессов [35]. От количества антиоксидантов, их физико-химических свойств, от взаимодействия их между собой и компонентами клетки, зависит антиокислительная активность (АОА) липидов. Информативным показателем является величина АОА липид-пигментного комплекса (ЛПК) растений, измеряемая методом ингибирования термического окисления модельной системы — метилолеата и отражающая действующую концентрацию липофильных антиоксидантов [21]. Фиксация образцов листьев в жидком азоте позволила повысить точность и надежность определения интенсивности как радикальных, так и антиокислительных процессов [20-21]. Как показано Бурлаковой Е.Б. с сотр.[36], изменение антиокислительной активности (АОА) суммарной липидной системы адекватно изменениям АОА липидов мембранных фрагментов субклеточных органелл. Величина АОА липид-пигментного комплекса (ЛПК) растений, измеряемая методом ингибирования термического окисления модельной системы — метилолеата, отражает действующую концентрацию липофильных антиоксидантов. Поэтому уровень липофильных антиоксидантов в ЛПК, выделенных из навески замороженных листьев, может служить показателем АОА липидов, сосредоточенных в мембранной системе зеленого листа в момент взятия пробы. Исследованиями Бурлаковой с сотр. [35] показана однотипность, неспецифичность и общность в изменении АОА при самых разнообразных воздействиях на организм - облучение, стресс, гипероксия, злокачественный рост и др.
Тарусов Б.Н. предположил, что уровень антиоксидантов, или АОА является фактором, сдерживающим радикальное окисление и определяющим надежность организма [37]. Если происходит повреждение в системе антиоксидантов, то их количество уменьшается и параллельно наблюдается всплеск и рост выхода свободных радикалов. Эти две кривые носят зеркальный характер. Состояние организма можно определить как по кривой содержания свободных радикалов, так и по кривой АОА. На этом принципе построена антиоксидантно-радикальная теория, на основе которой были созданы методы определения устойчивости живых организмов к различным неблагоприятным факторам среда.
Поскольку динамика изменений концентрации СР и ПК Мn+2 различающихся по устойчивости растений хлопчатника (сорта 108-Ф и разновидности nervosum) показала слабовыраженную ответную реакцию на 7-й день после инфицирования [20], нами было проведено изучение параметров СР и АОА у контрастных по устойчивости к расе I гриба сортов хлопчатника /С-4727 и Кзыл-Рават/, начиная с первых суток после заражения [21].
Кинетические исследования радикальных и антиокислительных процессов в растениях хлопчатника различной вилтоустойчивости показали, что в контроле листовая ткань устойчивого сорта хлопчатника Кзыл-Рават характеризуется более высокой амплитудой колебаний уровня СР и биоантиоксидантов. Восприимчивые растения хлопчатника (сорт С-4727) показали меньшую интенсивность колебаний уровня СР и биоантиоксидантов, что свидетельствует об ослабленном энергообмене и пониженном уровне внутриклеточного окислительного метаболизма (рис. 8) [21].
Установлено, что в норме устойчивые сорта по сравнению с восприимчивыми характеризуются сниженным уровнем потребления кислорода и вместе с тем повышенной фосфорилирующей активностью [38]. Эти факты свидетельствуют o более высокой эффективности дыхания и прочности сопрягающего фактора в устойчивом организме, позволяющих растению не только устоять, но и компенсировать поражение. Изучение динамики окислительных и антиокислительных процессов в онтогенезе растений хлопчатника различной вилтоустойчивости показало, что для толерантных организмов характерен больший диапазон колебаний в уровнях СР и АОА [21]. Несмотря на снижение потребления кислорода, выносливые к инфекции растения в процессе жизнедеятельности генерируют более высокий уровень СР, контролируемый более активной антиоксидантной системой. Следовательно, в устойчивых организмах интенсифицируются как окислительные, так и антиокислительные процессы. Эти результаты согласуются с тем фактором, что способность генерировать свободные радикалы у липидов с повышенным уровнем АОА увеличена, т.е. у них существует потенциальная возможность более интенсивного окисления по сравнению с липидами с заниженной АОА [39]. В пользу наличия более мощной АО-системы в толерантных растениях свидетельствует также присущий им более высокий уровень оксидазной и пероксидазной активности [40].
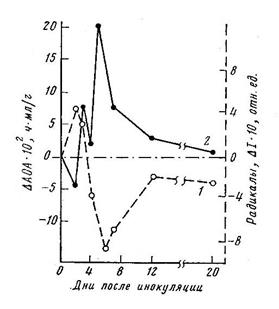
Динамика изменений дифференциальных показателей величины АОА, характеризующих опытные образцы по сравнению с контрольными, Δ АОА = АОАоп—АОАк , для двух сортов хлопчатника — устойчивого Кзыл-Рават (1) и восприимчивого к вилту С-4727 (2), в результате инфицирования грибом Verticcillium dahliae Kleb. ( раса 1, С = 3 млн спор/мл) показана на рис.9. Динамика АОА во времени носит колебательный характер и показывает различную ответную реакцию восприимчивого и устойчивого к вертициллёзу растений хлопчатника. На второй день после заражения величина Δ АОА для устойчивого сорта снижается, на третий и пятый дни увеличивается и на 28-й день устанавливается выше контрольного значения.
Для восприимчивого сорта наблюдается обратная картина — АОА на второй день повышается и на 28-й день становится ниже контроля.
В результате воздействия патогена на устойчивый сорт мембранные структуры стабилизируются с итоговым повышением АОА, а для восприимчивого сорта — уровень биоантиоксидантов снижается, в силу чего усиливаются патологические процессы и деградация клеток.
Изучение кинетики АОА ЛПК тех же сортов хлопчатника при воздействии малой дозы инфекционной нагрузки (0,5 млн спор/мл) показало, что уменьшение последней сохранило общую тенденцию изменений АОА с той лишь разницей, что при этом ослабление ответной реакции у обоих сортов отразилось Е относительном снижении амплитуды и увеличении времени наступления экстремальной величины /рис.10/. Меньшая доза инфекционной нагрузки вызывала замедление ответа по времени и снижение интенсивности сдвигов в амплитудах сигналов ПК Мn+2 как в устойчивых, так и в восприимчивых сортах [17]. Наши данные подтверждают немаловажное значение активации системы биоантиоксидантов, контролирующих процессы свободнорадикального окисления липидов в механизмах устойчивости растений к фитопатогенным поражениям [21].
|
|
Рис.9. Кинетика дифференциальных значений АОА ЛПК, (DАОА = АОАоп- АОАк) листьев растений хлопчатника при инфицировании грибом (нагрузка 3 млн.спор/мл): 1 – устойчивый -(Кзыл-Рават)/о—о/, 2 - восприимчивый - (С-4727) /D- -D/. | Рис.10. То же, с малой нагрузкой гриба – 0,5 млн спор/мл. |
Изменения в окислительном метаболизме при инфицировании хлопчатника грибом легче проследить по дифференциальным кривым изменения амплитуды сигналов СР и Мn+2 (∆I=Iоп- Iк), а изменения в уровне АОА — по динамике дифференциальных показателей величины АОА в опытных образцах по сравнению с контрольными (∆АОА=АОАоп—АОАК).
Результаты кинетического изучения окислительных и антиокислительных процессов в растениях устойчивого сорта хлопчатника приведены на рис. 11, восприимчивого — на рис. 12.
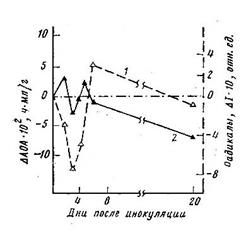
Устойчивые к данной расе гриба растения сорта Кзыл-Рават показали на 2-й день после заражения интенсификацию СРОП, выраженную положительным максимумом в изменении концентрации свободнорадикальных состояний в опытных растениях по сравнению с контрольными. При этом одновременно наблюдается начальное снижение величины АОА ЛПК с последующими колебаниями и итоговым ее повышением (рис. 11).
У восприимчивого сорта заражение грибом вызывает заболевание и патогенез. При инокуляции вирулентной для него расой 1 гриба Verticcillium dahliae Kleb. в стебель оказалось, что в листьях среднего яруса сдвиг окислительного метаболизма происходит на 2-е сутки в сторону торможения мембранного перекисного окисления со снижением концентрации свободных радикалов и парамагнитных ионов Мn+2. Антиокислительные процессы показали противоположную картину: происходит повышение АОА ЛПК с последующим снижением на 3—20-й день после заражения (рис.12).
|
|
|
|
Рис. 11. Дифференциальный анализ кинетики свободно-радикальных окислительных и антиокислительных процессов в растениях устойчи-вого сорта хлопчатника на ранних этапах взаимодействия с грибом: 1 – концентрация СР (ΔI = Iопыт - Iконтроль); 2 – ΔАОА = АОАопыт - АОАконтроль | Рис. 12. Дифференциальный анализ кинетики реципрокных процессов при заражении восприимчивого сорта хлопчатника: 1 - концентрация СР – ΔI; 2 - ΔАОА |
Вспышку окислительных процессов с одновременным снижением АОА в мембранных компартментах устойчивых организмов при контакте с патогеном правомерно отнести к качественному признаку процесса адаптации растения к данной инфекционной нагрузке, в результате которого растительный организм обретает более высокий антиоксидантный потенциал в потенциал в мембране, предохраняющий клетку от разрушения.
|
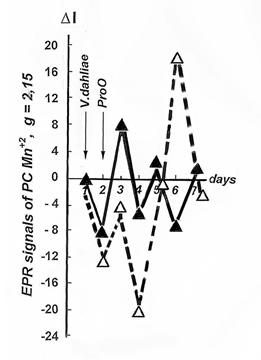
Рис.13. Кинетика дифференциальных зна-чений концентрации ПК Мn+2 у устойчиво-го (о—о) и восприимчивого (▲--▲) сор-тов хлопчатника при заражении вилтом. |
В восприимчивых растениях при воздействии патогена наблюдается снижение интенсивности СРОП в мембране, влекущее за собой распад имеющегося запаса АТФ, снижение биоантиоксидантного пула, итогом которого является повышение окисляемости и разрушение мембраны, обусловливающие патогенез и гибель растительного организма
Таким образом, усиление мембранной пероксидации липидов с последующей мобилизацией синтеза антиоксидантов может служить триггером адаптивных реакций организма.
Реакции устойчивости характерно увеличение интенсивности СРОП сразу на 2-й день после инфицирования.
Реакция восприимчивости, наоборот, характеризовалась ответным снижением интенсивности СРОП на 2-й день после инфицирования (рис. 13)
Парадокс состоит в том, что в реакции несовместимости устойчивого растения партнёр воспринимается как хаотропный агент, вызывающий окислительную деструкцию и всплеск радикалов, что индуцирует в последующем адаптациогенез и коэволюцию. В то время как в реакции совместимости у восприимчивого сорта происходит контакт с патогеном, вызывающий тушение уровня СР, с последующим регрессом и даже гибелью растения. Детерминантной фазой адаптациогенеза является всплеск деструктивных радикальных процессов в первые же сутки после инфицирования грибом вилта. На основании изучения кинетики радикальных процессов разработан способ определения устойчивости хлопчатника к вилту [41]. В то же время устойчивость можно определить и по динамике изменения АОА ЛПК растений [42], и по кинетике изменения концентрации водорастворимых антиоксидантов в течение недели после инфицирования патогеном [43].
4. Реактивность – специфическое свойство живых систем
Физиолого-биохимические исследования иммунитета растений показали, что их устойчивость связана не только со структурной стабильностью мембран [44, 45], но и со способностью мембранных структур «узнавать» патоген, т.е. с чувствительностью к патогену или его метаболитам [7, 46]. Впервые о надёжности клеток и тканей и роли биоантиоксидантов в регуляции метаболизма в норме и патологии заявили украинские учёные - Тарусов Б.Н., Журавлёв А.И. Гродзинский Д.М. - в 1980-1983 гг. [37], но о надёжности как целостной категории, объединяющей противоположные взаимодополнительные критерии устойчивости и реактивности, структурный и функциональный, было заявлено в 1990 г. [7].
Чувствительный ответ растения на воздействие патогена, скорость ответной реакции, несомненно, связаны с функциональным свойством мембран – реактивностью. Качественно различные реакции совместимости и несовместимости растений на воздействие одного и того же патогена могут быть обусловлены в первую очередь скоростью ответной реакции, т.е. реактивностью мембранных структур растительной клетки.
Парадоксальный факт существования в клетке ферментных систем, усиливающих деструктивные процессы, т.е. «несущих смерть», обретает смысл в повышении реактивного функционального состояния. Системы генерации высокореактивных форм кислорода и радикалов [7, 10, 47], повышающие реактивность мембранных структур, так же необходимы клетке для реализации надежности функционирования защитных систем, целостности и индивидуальности клетки, как и системы детоксикации активных форм кислорода (супероксиддисмутазы, каталазы, пероксидазы), входящие в состав ферментативной антиоксидантной защиты клетки и повышающие ее устойчивость.
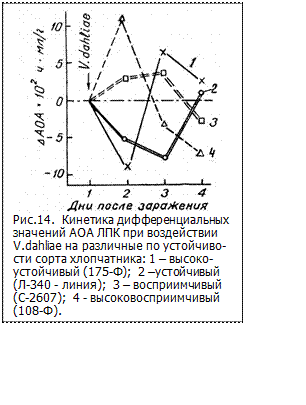
Изучение реакции на заражение грибом двух устойчивых и двух восприимчивых сортов хлопчатника по изменению АОА ЛПК показало, что эти изменения имеют специфический характер. Компенсационный уровень повышения концентрации биоантиоксидантов (БАО) достигается разными по устойчивости сортами в разное время - в зависимости от генетически наследованной реактивности мембранных структур [48]. Как видно из рис.14 у высокоустойчивого сорта наблюдается компенсация в уровне АОА уже на 3-е сутки вслед за ответным снижением его на 2-е сутки после заражения. Для менее устойчивого сорта компенсация в уровне АОА достигается только на 4-й день после предварительного замедленного снижения его на 3-е сутки. Для восприимчивых сортов наблюдается сначала повышение АОА, затем снижение ниже контрольного уровня, тем большее, чем более восприимчив сорт (рис.14).
Таким образом, чем больший сдвиг по интенсивности и продолжительности имеется при поражении патогеном, тем замедленнее идёт его компенсация. По изменению амплитуды колебаний ΔАОА ЛПК образцов на второй, третий и пятый дни после инфицирования по сравнению с эталонным предложен способ диагностирования устойчивости растений к фитопатогенным поражениям, позволяющий количественно оценить устойчивость к патогену [42].
Предложенный метод отражает непосредственную ответную реакцию мембранных структур растений хлопчатника на воздействие инфекционной нагрузки определенной дозы и агрессивности, что важно для прогнозирования патогенности паразита и вилтоустойчивости растения-хозяина.
Скорость компенсирующего нарастания АОА может служить характеристикой реактивности мембранных структур растения. Избыточная реактивность мембранных структур усиливает колебания и затрудняет к возвращению до уровня контроля.
 Ослабленная реактивность ведет к денатурации мембранных структур и может легко перейти в состояние восприимчивости. При продолжительном контакте с патогеном, что наблюдается при эпифитотиях, мембранные структуры постепенно ослабляют реактивность и становятся более восприимчивыми.
Ослабленная реактивность ведет к денатурации мембранных структур и может легко перейти в состояние восприимчивости. При продолжительном контакте с патогеном, что наблюдается при эпифитотиях, мембранные структуры постепенно ослабляют реактивность и становятся более восприимчивыми.
По-видимому, ориентация мембранных структур на "хаотропность" чужеродного агента и высокая чувствительность процессов ПОЛ к факторам внешней среды могут лежать в основе механизма реактивности мембран. Вполне допустимо, что оптимальная реактивность и чувствительность мембранных структур к "хаотропным" агентам могут запускать реакцию сверхчувствительности при механических, физических и фитопатогеных поражениях.
В связи с вышесказанным задача повышения устойчивости растений к фитопатогенам может быть непосредственно связана с проблемой усиления реактивности мембран, закаливания дозированными воздействиями "хаотропных" агентов, имеющих подобие о фитопатогенами.
Кинетические исследования окислительных и антиокислительных процессов в динамике взаимоотношения растения-хозяина с патогеном могут помочь не только в диагностике и оценке устойчивости растений к фитопатогенным поражениям, но и выявить эффективность конкретных мер для повышения реактивности мембранных структур и устойчивости растительного организма [17].
С целью повышения реактивности и повышения уровня СРОП было проведено опрыскивание зараженных растений восприимчивого сорта хлопчатника (С-4727) 0,1%-ным раствором смеси (Fe+2 + аскорбиновая кислота), обладающей прооксидантными свойствами. В результате обработки наблюдается замедление во времени появления видимых признаков заболевания. Изучение интенсивности СРОП по определению концентрации ПК Мn+2 показало, что обработка прооксидантами приводит к интенсификации их на 5-е сутки, в то время как у больных растений, не подвергавшихся обработке, этот показатель оставался ниже уровня контрольных растений (рис.15).
Для компенсации уровня биоантиоксидантов в фазе их снижения проводили обработку раствором природного антиоксиданта хлопчатника - госсипола (1%-ный раствор в 0,07 %-ном растворе буры) зараженных растений устойчивого сорта хлопчатника (Кзыл-Рават). Обработка антиоксидантом инфицированных растений хлопчатника устойчивого сорта в фазе их снижения (на 2-е сутки после заражения) показало увеличение биоантиоксидантного пула на 6-е сутки, по сравнению с необработанными растениями, что приводит к сохранению устойчивости /рис.16/.
|
| |
|
| |
Рис.15. Кинетика дифференциальных значений концен-трации ПК Мп+2 ( ∆I = I оп - I контр) восприимчивого сорта хлопчатника, зараженного грибом, нагрузка 0,5 млн.спор/мл (▲--▲); при обработке прооксидантом PrO - (D—D). | Рис.16. То же для устойчивого сорта хлопчатника, зараженного грибом, нагрузка 0,5 млн.спор/мл (●—●) и действии антиоксиданта AntiO – (о - -о). | |
Кинетический анализ последействия гриба Verticillium Dahliae Kl. на различные сорта хлопчатника показал возможность прогнозирования надежности иммунитета по скорости ответной реакции, соответствующей критерию реактивности, и степени ее замедления, соответствующей критерию устойчивости [49-53]. Анализ ответа растений на неспецифическое воздействие позволил разработать способ определения надёжности жизнеобеспечения [54].
На рис. 17 представлена кинетика изменения величин удельных сопротивлений (ω) черешков растений со временем ускоренного увядания для хлопчатника сорта 108-Ф, выращенного до 2-х месячного возраста в лизиметрах ИПА АН УзССР на различных агрофонах: 1 – без удобрений; 2 – NPK; 3 – органика; 4 – РК-навоз
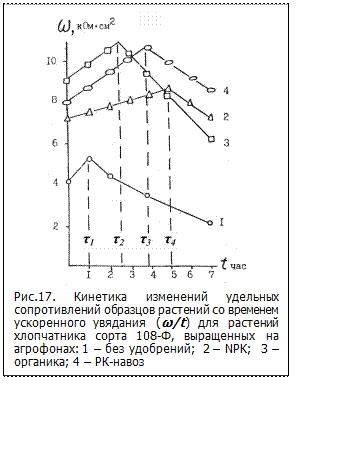 По величинам удельных сопротивлений черешков растений (ω) каждого варианта опыта в течение всего периода ускоренного старения и гибели составляют таблицу и строят график кинетической зависимости изменения удельного сопротивления от времени завядания (ω/t), которая имеет вид экстремальной кривой с максимумом ωmax в момент гибели живых клеточных структур и необратимым увеличением выхода ионов (соответственно, снижением ω) в последующее время. Из анализа зависимости ω/t определяют следующие количественные параметры: начальное сопротивление ω0; время наступления максимального значения удельного сопротивления (τ) - критерий устойчивости (КрУ); скорость прижизненного нарастания удельного сопротивления - критерий реактивности (КрР); интегральную мощность сопротивления в первый час завядания - критерий жизнеспособности (КрЖ).
По величинам удельных сопротивлений черешков растений (ω) каждого варианта опыта в течение всего периода ускоренного старения и гибели составляют таблицу и строят график кинетической зависимости изменения удельного сопротивления от времени завядания (ω/t), которая имеет вид экстремальной кривой с максимумом ωmax в момент гибели живых клеточных структур и необратимым увеличением выхода ионов (соответственно, снижением ω) в последующее время. Из анализа зависимости ω/t определяют следующие количественные параметры: начальное сопротивление ω0; время наступления максимального значения удельного сопротивления (τ) - критерий устойчивости (КрУ); скорость прижизненного нарастания удельного сопротивления - критерий реактивности (КрР); интегральную мощность сопротивления в первый час завядания - критерий жизнеспособности (КрЖ).
Надежность жизнеобеспечения растений определяется соотношением критериев устойчивости, реактивности и жизнеспособности. При этом высокую надежность жизнеобеспечения обнаруживают растения, если КрЖ > 5кОм·см2·ч, а время наступления максимума удельного сопротивления более чем втрое превышает скорость нарастания удельного сопротивления (КрУ/КрР > 3,0); растения относят к малонадежным, если КрЖ < 5 кОм·см2•ч и КрУ/КрР < 3,0 [54].
Функциональное состояние растения оценивается по трем количественным критериям с четкой характеристикой степени надежности жизнеобеспечения. Так как фактором ускоренного старения выбрано обезвоживание при повышенной (35°С) температуре, то именно к этим условиям определяют: критерий жизнеспособности - как потенциальный запас сопротивления гибели; критерий устойчивости - как время продолжительности сохранения живых структур, в течение которого удерживается выход ионов в условиях ускоренного старения; критерий реактивности - как мера отзывчивости и скорости ответных реакций для мобилизации "жизненного потенциала" растений; степень надежности - по абсолютной величине критерия жизнеспособности и отношению количественных критериев устойчивости и реактивности. Таким образом, оценка 3-х критериев и степени надежности жизнеобеспечения дает полную характеристику истинного функционального состояния растения, изменяющегося на каждой фазе вегетационного развития.
Способ позволяет в минимальные сроки (7-10 ч) определить количественные параметры надежности жизнеобеспечения испытуемых сельхозкультур, оценить степень надежности, распознать причинный характер ее вариаций и выполнить целенаправленный отбор растений с требуемыми хозяйственно-ценными и физиологическими качествами [54-55].
Дифференцированный ответ на неспецифическое воздействие (разрыхление клеточной стенки липофильным растворителем), т.е. анализ мембранной реактивности сенсибилизированных семян, позволил предложить способ определения трудновсходимых семян хлопчатника в опытной партии, который может быть широко использован в контрольно-семенных лабораториях для экспресс-анализа посевных качеств семян [56].
Оптимальная реактивность обеспечивает партнерам динамической системы растение-хозяин - патоген не только целостность и индивидуальность, но и возможность прогрессивного адаптациогенеза и сопряженной эволюции с партнером. Взаимоадаптация значительно повышает надежность системы высших и низших растений – этим объясняется долговечность очень древнего симбиоза водоросли и гриба – лишайников [57]. При снижении реактивности хозяина мутуалистический симбиоз партнеров системы переходит в паразитизм с преждевременным увяданием и гибелью растения-хозяина. Однако даже при подходящих климатических и почвенных условиях патоген будет заселять только физиологически мощные растения, способные удовлетворить потребности паразита в его питании для осуществления полного репродуктивого цикла; взамен потери иммунности (невосприимчивости) паразит обеспечивает хозяину возможность прогрессивного адаптациогенеза [58-59]. Меньшие дозы либо отсутствие фактора адаптациогенеза могут ослабить реактивность хозяина и усилить жесткость, т.е. устойчивость его мембран.
Избыточная жесткость, стабильность мембранной организации будут препятствовать гибкости метаболизма, поливариантности компенсаторных решений в критических экстремальных условиях, снижать жизнеспособность и биологическую надежность высших растений.
Естественный отбор закрепляет у растений механизмы надежной защиты, реактивности и устойчивости к паразитам, а у последних – механизмы изменчивости, позволяющие преодолевать эту защиту [52, 53]. Таким образом, движущим фактором эволюции низших растений и микроорганизмов может быть высокая изменчивость и лабильность мембранных структур и генов вирулентности, способных продуцировать все новые молекулы супрессоров или изменять до неузнаваемости старые, способные снижать при контакте стационарный уровень СРОП и реактивность мембран хозяина.
| ||||||||
Рис. 18. Схема взаимосвязи категорий биологической надёжности и изменчивости с критериями устойчивости и реактивности.
На рис. 18 выведена модифицированная схема взаимосвязи категорий биологической надёжности с критериями реактивности и устойчивости [7, рис. 4]. Из этой схемы совершенно очевидно возникновение явления реактивности только для живых систем, для неживых – устойчивых (скалы, твёрдые породы, кристаллы и пр.) отводится ареал в координатах УСТОЙЧИВОСТЬ–ПАССИВНОСТЬ. Для лабильных систем неживых (вулканы, грозы, молнии, торнадо, моря, тайфуны, ядерные процессы и пр.) отводится ареал в координатах НЕУСТОЙЧИВОСТЬ – ПАССИВНОСТЬ.
Для живых систем оптимальное соотношение критериев устойчивости и реактивности (в межпороговом пространстве значений) определяет диапазон высокой надежности биологических свойств системы высших растений – ареал в координатах УСТОЙЧИВОСТЬ - РЕАКТИВНОСТЬ. Оптимальное соотношение критериев реактивности и лабильности (неустойчивости) может определить диапазон оптимальной изменчивости, обеспечивающей жизнеспособность и адаптивную эволюцию низшим растениям и микроорганизмам – в ареале с координатами НЕУСТОЙЧИВОСТЬ - РЕАКТИВНОСТЬ. Внепороговые величины параметров устойчивости, лабильности и реактивность могут снижать жизнеспособность биосистемы вплоть до гибели. Следовательно, реактивность и чувствительность мембранных структур как хозяина, так и паразита является движущим фактором жизнеспособности и сопряженной эволюции партнеров динамической системы растения-хозяина и патогена.
Эволюция высших растений заключается в надежности реализации механизмов устойчивости и реактивности мембранных структур, мобилизующих реактивный ответ. Из рис.18 очевидно, что реактивность мембранных структур является облигатным критерием надёжности функционирования защитных систем высших организмов – эукариотов растений, животных, и изменчивости низших – прокариотов, грибов, бактерий [7].
5. Энтропийные и антиэнтропийные процессы в биосистемах.
Великий Больцман установил фундаментальное соотношение между энтропией физической системы и вероятностью её состояния в своей знаменитой формуле S= klnW, впервые связал энтропию с неупорядоченностью и указал на несостоятельность гипотезы «тепловой смерти» Вселенной [60]. Норберт Винер утверждает: энтропия - мера хаоса, количество информации - мера упорядоченности. Энтропия и информация рассматривают мир в соотношении хаоса и упорядоченности [61].
Под влиянием работ Л. Бриллюэна [62], начиная с шестидесятых годов ХХ в., возник и приобрел широкую известность «негэнтропийный принцип информации». В отличие от энтропии, рассматриваемой в качестве меры неупорядоченности той или иной системы, негэнтропией обычно называют меру упорядоченности окружающих нас систем, связывая с ней различного рода антиэнтропийные процессы, протекающие в физическом мире. «В простом понимании, энтропия — хаос, саморазрушение и саморазложение. Соответственно, негэнтропия — движение к
упорядочиванию, к организации системы [63]. По отношению к живым системам: для того, чтобы не погибнуть, живая система борется с окружающим хаосом путем организации и упорядочивания последнего», продуцируя информацию в большем объёме, чем энтропию. Л. Бриллюэн сформулировал утверждение, согласно которому информация – это не что иное, как энтропия с обратным знаком, или негэнтропия[64].
Если энтропия — мера беспорядка, дезорганизации в системе, какой показатель может быть использован в качестве меры ее организованности, упорядоченности? Что в мире может противостоять энтропийным процессам? Клод Шеннон (1948) ввел понятие информации как меры уменьшения неопределенности, энтропии. В системе значений термина «информация» появилась новая позиция — количественная мера устранения энтропии (неопределенности), мера организации системы [65].
Таким образом возникло определение энтропии как меры «беспорядка», «дезорганизации» биологической системы, а информации — как меры организации.
«Сегодня мы знаем, что увеличение энтропии отнюдь не сводится к увеличению беспорядка, ибо порядок и беспорядок возникают и существуют одновременно, … порядок и беспорядок сосуществуют как два аспекта одного целого и дают нам различное видение мира», - так пророчески предсказал Илья Пригожин [66].
Тогда окислительные, деструктивные процессы, ведущие к дезорганизации и беспорядку, можно отнести к энтропийным процессам, а восстановительные, АО-процессы с накоплением информации – можно отнести к антиэнтропийным, или информационным процессам.
Хаотропное возмущение приводит к окислительной деструкции мембранных фрагментов, увеличению проницаемости кислорода во внутриклеточное пространство и усилению СРОП мембран. Примерами неспецифического хаотропного воздействия являются облучение, гипертермия. Тогда повышение уровня деструктивных процессов, мембранной пероксидации и дыхания можно отнести к энтропийным процессам, вызывающим «хаос» и деструкцию мембранной и клеточной структуры. Компенсаторно-восстановительные процессы, индуцируемые через определенный промежуток времени, отражаются в повышении уровня АОА, накопления ц-АМФ и активации ферментных комплексов. Их можно отнести к антиэнтропийным процессам, повышающим упорядоченнность биологических структур.
Компартментализация и реципрокность энтропийных и антиэтропийных функций в мембранах и клетках обуславливают специфичность кинетики каждого процесса.
Так, кинетика изменения концентрации опухолевых маркеров - раково-эмбрионального антигена (РЭА) и альфа-фетопротеина (АФП) в сыворотке крови женщин - больных РМЖ III-IV стадий, получавших лучевую и комплексную химиолучевую терапию, свидетельствует об участии РЭА в деструктивных, энтропийных процессах под действием лечения, а АФП – в антиэнтропийных,компенсаторно-восстановительных, - противоположно мнению авторов работы. На это указывает антибатно направленная специфическая кинетика этих процессов в ходе изучения последействия лечения больных [67].
Реципрокность энтропийных и антиэнтропийных функций легко проследить по сопряжённым процессам дыхания и гликолиза, расщепления и синтеза АТФ, свободнорадикальных и антиокислительных процессов и пр.
Таким образом мерой разупорядоченности биосистемы может служить повышение интенсивности энтропийных функций и, соответственно, мерой упорядоченности биоструктур - интенсивность антиэнтропийных процессов [7]. Антиэнтропийные, информационные функции клетки и организма заключаются в развёртывании во времени восстановительных функций на всех уровнях биологической интеграции: физико-химической, ферментативной, клеточной и популяционной репарации. Динамический баланс энтропийных и антиэнтропийных процессов, его кинетические параметры определяют жизнеспособность и надёжность иммунитета растений [68] и реализуется в двух-компартментальной модели функционирования мембранных и клеточных систем живых организмов [7].
Именно накопление информации, а не вещественная и энергетическая стороны процесса, играет в эволюции жизни решающую роль. Прогрессивное развитие, в ходе которого из простого возникает все более сложное, "представляет собой в своей сущности процесс интеграции рассеянной информации" [69].
6. Радикалы как диссипативные структуры - фактор реактивности энтропийных локусов и изменчивости биосистем.
Химия свободных радикалов является важнейшим аспектом фагоцитоза, воспаления и апоптоза. Клеточный суицид, или апоптоз, - это путь организма к контролю клеточной смерти, который включает свободные радикалы и redox signaling [32]. Радикалы играют даже большую роль и в таких формах клеточной смерти, как некроз и аутораспад [70].
Исследования процессов присоединения и переноса низкоэнергетических электронов к кислотам, содержащим легкорегулируемую поляризованную связь, показали участие одноэлектронных ретрансляторов в межмолекулярном переносе электрона с образованием промежуточных радикальных продуктов. Образование короткоживущих неустойчивых радикалов – непременное условие в механизмах окислительно-восстановительных реакций, имеющих универсальное значение в метаболизме живых систем [71].
Одноэлектронный перенос достаточен для переключения и перестройки конформации ансамбля тубулинов в микротрубочках нейронов мозга из одного состояния в другое (возможно, из энтропийного в информационное) при реализации "момента сознания" [72]
Недавние исследования показали, что антиоксидантная терапия не имеет лечебного эффекта и может даже увеличить смертность. Более того, недавние исследования, проследившие за питанием 478 000 европейцев, потреблявших много фруктов и овощей, подчеркнули, что это не имело влияния на предотвращение рака [70]. Антиоксиданты применяют не для уничтожения «вредных» радикалов, а для повышения АО-потенциала системы. Только рассматривая биосистему как целостную систему, можно регулировать баланс Redox-систем в организме. Так, с открытием универсальной роли оксида азота предложен механизм регуляции баланса антиоксидантных и прооксидантных процессов в биологических системах через образование и деструкцию динитрозильных комплексов железа [73]. Обнаружение корреляционной взаимосвязи фармакологического действия психотропных препаратов ряда фенотиазина с их электронодонорными свойствами (потенциалом ионизации - в апротонныой среде с образованием катион-радикалов) свидетельствует о непосредственном участии радикалов в механизмах передачи нервного импульса, холинолитической активности [74-78].
Таким образом, свободнорадикальные процессы являются непременным атрибутом жизненных процессов так же, как и антиоксидантные системы – на молекулярном, мембранном и клеточном уровнях биосистем.
Радикалы - высокореактивные неустойчивые молекулы с неспаренным электроном – являются именно теми диссипативными структурами в биологических тканях, которые обеспечивают изменчивость и мутабильность биосистем. «Известно, что около 98% кислорода, потребляемого митохондриями при дыхании, превращается в воду, в то время как оставшиеся 2% дают супероксид (O2 ▬ •) за счет паразитных химических реакций, происходящих в начале и середине дыхательной цепи. Из супероксида затем образуются перекись водорода (H2O2) и гидроксил-радикал (ОН•) - сильнейший окислитель, который разрушает любые вещества живой клетки. По одной из наиболее популярных в настоящее время гипотез старения организма именно с образованием активных форм кислорода (АФК), таких как ОН•, связан этот процесс [79]. Но это не «паразитные химические реакции», а необходимый ресурс для генерации радикальных продуктов. «АФК - главные мутагены аэробных клеток. Повышенный мутагенез не только уменьшает продолжительность жизни, но и увеличивает генетическое разнообразие потомства» [79]. Именно радикальные промежуточные соединения являются основным фактором реактивности энтропийных локусов и изменчивости биосистем. Их действующая концентрация обеспечивает энтропийный потенциал системы (так же как «хаотический потенциал» обеспечивает творческий потенциал личности) [80].
Парадоксальный факт существования в клетке ферментных систем, усиливающих деструктивные процессы, т.е. «несущих смерть», обретает смысл в повышении реактивного функционального состояния. Системы генерации высокореактивных форм кислорода и радикалов, повышающих реактивность мембранных структур, также необходимы клетке для реализации надежности функционирования защитных систем, целостности и индивидуальности клетки, как и системы детоксикации активных форм кислорода (супероксиддисмутазы, каталазы, пероксидазы), входящие в состав ферментативной антиоксидантной защиты клетки и повышающие её устойчивость [7].
7. Компартментализация функций устойчивости и реактивности в биосистемах. Биоритмы.
Исследование кинетики окислительных и антиокислительных процессов в динамике взаимоотношений растение-хозяин - паразит показало на ранних этапах инфицирования патогеном зеркально-антибатную кинетику противоположно ориентированных процессов, отразившуюся в динамике изменений концентраций СР и антиоксидантов [7, 21].
При нормальных условиях в организме сохраняется равновесие между скоростью образования свободных радикалов, ПОЛ и активностью антиоксидантной системы (витамины Е, С, В, супероксиддисмутаза, каталаза, глутатионтрансфераза, глутатионпероксидаза, глутатионредуктаза и др.), что является одним из основных показателей гомеостаза [26, c.155].
О балансе процессов перекисного окисления липидов (ПОЛ) и антиокислительной активности (АОА) в организме рыб подчёркивается Рудневой И.И. [81], причём высокий уровень АОА характерен для более молодых рыб по сравнению со старыми, а также для тканей органов с высокой скоростью метаболизма (печень, сердце, селезёнка, мозг). Эти результаты согласуются с тем фактом, что способность генерировать свободные радикалы у липидов с повышенным уровнем АОА увеличена, т.е. у них существует потенциальная возможность более интенсивного окисления по сравнению с липидами с заниженной АОА [39].
Налицо явный парадокс: по логике вещей, чем больше АОА, тем меньше в системе должно быть радикалов, так как антиоксиданты обрывают и «тушат» цепные радикальные реакции [10]. Этот парадокс может быть разрешим только при условии различной компартментализации и пространственного разделения процессов противоположной, реципрокной направленности. Активные центры окислительных и антиокислительных процессов в силу их противоположной функции должны локализоваться в различных компартментах мембранных и клеточных структур.
Развитие окислительного стресса можно рассматривать как нарушение существующего в оптимальных условиях внутриклеточного баланса между уровнем радикалов, АФК и системами антиоксидантной защиты клетки. В последнее время все более популярной становится гипотеза, согласно которой адаптация растений к действию стрессоров различной природы в значительной степени зависит как от функционирования антиоксидантных ферментов, таких как супероксиддисмутаза (СОД), гваяколовые пероксидазы (ПО), каталаза, аскорбатпероксидаза и другие ферменты, так и от накопления в клетках низкомолекулярных антиоксидантов (пролина, полиаминов, токоферола, сахаров, аскорбиновой кислоты, фенолов) [82].
Обнаруженная антибатность и повышенная интенсивность одновременно окислительных и АО-процессов в иммунных организмах могут проявляться только при единственном условии: различной локализации систем, отвечающих за эти функции, т.е. структурной компартментализации окислительных и АО-центров в мембранных и субклеточных фрагментах. Носителями этих двух противоположных свойств могут быть липиды мембран, амфипатические по своей природе, так как, с одной стороны, ввиду двойных связей в гидрофобных участках они могут легко окисляться, а с другой стороны, благодаря АО-свойствам полярных групп липидов и липорастворимых антиоксидантов могут тормозить окисление [35]. Активные центры окислительных и антиокислительных процессов в силу их противоположной функции локализованы в разных компартментах мембраны и клетки.
Сочетание гидрофильных и липофильных свойств в структуре одной молекулы обуславливает амфифильность молекулы. Амфифильность (иначе дифильность) — свойство молекул органических веществ, обладающих одновременно лиофильными (в частности, гидрофильными) и лиофобными (гидрофобными) свойствами [83]. Как правило, гидрофобная часть амфифильного соединения представляет собой длинную неразветвлённую углеводородную цепь CH3 (CH2)n, где n > 4, а гидрофильная — полярную функциональную группу типа COOH или ион небольшого размера, например, COO- или N (CH3)3+. Существование полярной и неполярной частей молекулы способствует агрегации частиц с образованием мицелл, бислоёв и других структур. Амфифильными свойствами обладают поверхностно-активные вещества (ПАВ), липиды, многие пептиды,белки, биополимеры. Из амфифильных липидов состоят все известные мембраны – природные и искусственные [83].
Компартментализация этих процессов и обнаруженная реципрокность могут свидетельствовать o наличии регуляторной связи и динамического равновесия между компартментами с противоположно ориентированными функциями в мембране и клетке. Воздействие хаотропного фактора приводит к нарушению естественного баланса этих двух функций, в первую очередь, на мембранном уровне. Тогда радикалы, как хаотропные агенты, усиливают потенциал компартмента реактивности. Действие экзогенных и эндогенных антиоксидантов направленно усиливает антиокислительный потенциал компартмента устойчивости в живых системах [7, 17].
По-видимому, двухкомпартментальная модель мембранных процессов с разделением реципрокных функций – окислительных и антиокислительных может служить также базой для реализации механизмов клеточной ритмики многих биохимических параметров [84].
Двоичностъ компартментализованных функций является предпосылкой для возникновения как естественных биоритмов, так и колебаний, индуцированных внешним воздействием. Наличие двухфункционального динамического равновесия объясняет механизмы клеточной ритмики различных биохимических параметров. Математический анализ простой двухкамерной модели подтвердил возможность околочасовой колебательной динамики системы при условии различной локализации компартментализованных активностей и возможность возникновения автоколебательного режима. Так возникают автоколебательные процессы в мембранных и клеточных структурах. Колебательные процессы были обнаружены даже в химически гомогенной системе - в окислительной реакции Белоусова-Жаботинского . В ходе этой реакции выделяется сильный ингибитор, останавливающий реакцию после того как исчерпана лишь небольшая доля (0,01) реагентов. После распада ингибитора за счет медленных процессов окисление субстрата запускается снова [64, с.19] .
Э. Бауэром был сформулирован «Всеобщий закон биологии»: «Для живых систем характерно именно то, что они за счет своей свободной энергии производят работу против ожидаемого равновесия». Доброборским Б.С. сформулирован второй закон биологии: «Устойчивость неравновесного термодинамического состояния биологических систем обеспечивается непрерывным чередованием фаз потребления и выделения энергии посредством управляемых реакций синтеза и расщепления АТФ» [84].
Из этого закона следует:
1. В живых организмах ни один процесс не может происходить непрерывно, а должен чередоваться с противоположно направленным: вдох с выдохом, работа с отдыхом, бодрствование со сном, синтез с расщеплением и т.д.
2. Состояние живого организма никогда не бывает статическим, а все его физиологические и энергетические параметры всегда находятся в состоянии непрерывных колебаний относительно средних значений как по частоте, так и по амплитуде.
Эти колебания и являются биоритмами. Основой биоритмов являются непрерывные чередования фаз потребления и выделения энергии посредством управляемых реакций синтеза и расщепления АТФ, направленные на обеспечение устойчивого неравновесного термодинамического состояния биологических систем. Можно считать, что биоритмы являются способом существования всех живых организмов. Но в базовой основе биологических ритмов макропроцессов заложены пульсация и обмен информацией между 2-мя пространствами – компартментами, в которых реализуются микропроцессы противоположной направленности – энтропийные и антиэнтропийные, т.е. информационные процессы.
8. Динамический баланс энтропийных и информационных процессов – качественная специфичность живых систем.
На заре XX века выдвинуто положение о том, что качественно новый уровень материи возникает в результате возникновения новых структурных связей и отношений в рамках предшествовавших, уже существовавших форм материи, что и приводит к появлению целостных систем нового типа. Энгельгардт В.А. в 1969 г. писал, что именно в способности живого создавать порядок из хаотического темнового движения молекул состоит глубокое, коренное отличие живого от неживого [85].
«Сравнивая круговороты в природе, М.М.Камшилов нашёл, что "главное отличие биотического круговорота от любого другого, в частности от круговорота воды, как раз и заключается в том, что он происходит на всех уровнях в итоге устойчивого взаимодействия противоположных процессов: синтеза и деструкции молекул, рождения и гибели особей, появления и отмирания видов". Единство и устойчивость жизни обусловливается всей совокупностью систем жизни [86]. Становится очевидным, что противоречие между безграничной способностью к размножению (давление жизни) и ограниченными возможностями использования на данном этапе новых материальных средств к существованию "разрешается на базе изменчивости и естественного отбора путем овладения все новыми и новыми источниками жизнедеятельности, что ведет к прогрессивному расширению взаимодействия между биотическим и абиотическим, к постоянным перестройкам биотических отношений и среды жизни, к накоплению информации” [86].
На недавней конференции ISSS (2011 г.) было высказано: «В мире существуют две противоположные силы, которые постоянно взаимодействуют друг с другом, создавая поток энергии, вещества и информации между системами и окружающей средой. С одной стороны, мы имеем силу беспорядка, управляемую вторым законом термодинамики, уносящую всё в равновесное состояние с максимумом энтропии. С другой стороны, мы имеем организационную силу, управляемую ограничениями системы, которая вовлекает систему в особенное устойчивое состояние с низкой энтропией» [87].
Динамизм и интенсивность энтропийных процессов – распада, и антиэнтропийных – синтеза – впечатляющие и по скорости, и по интенсивности. Синтез и распад биомолекул происходит непрерывно на протяжении жизни живого организма [26]:
o У взрослого человека ежечасно отмирает миллиард эритроцитов, 5 миллиардов лейкоцитов и 2 миллиарда тромбоцитов. На смену им приходят новые клетки, вырабатываемые в костном мозге и в селезенке. За сутки заменяется примерно 25 граммов крови.
o Ежесекундно, в среднем отмирает около 400 000 клеток кожи и столько же синтезируется.
В теле человека работает не менее 700 ферментов [21]. Насколько ферменты ускоряют биопроцессы, свидетельствуют факты [1]:
o Белок, содержащий тысячи аминокислот, в живой клетке эукариот синтезируется за 56 мин.
o Благодаря комплементарности пуринов и пиримидинов одна цепочка РНК или ДНК может выстроить на себе свое зеркальное изображение. Способность к самокопированию у этих молекул не имеет себе равных в мире органических соединений. Конвариантная редупликация ДНК происходит по матричному принципу с участием фермента ДНК-полимеразы. На самосборку ДНК кишечной палочки (Escherichia соli), состоящей примерно из 40 тыс. пар нуклеотидов, требуется вceгo 100 сек.
Акад. Эрик Галимов утверждает, что в живой природе действует наряду со вторым законом термодинамики – законом разупорядочения – сопряжённый с ним закон непрерывного упорядочения [88], который совершенно очевидно согласуется с информационно-энтропийной моделью функционирования живых систем.
Причём неустойчивые, лабильные агенты и промежуточные вещества, в т.ч. радикалы, их реактивность обуславливают оптимальную изменчивость, а структура и функции устойчивых биоструктур обеспечивают высокую надёжность функционирования целостным биологическим системам.
Именно накопление информации, а не вещественная и энергетическая стороны процесса, играет в эволюции жизни решающую роль. Прогрессивное развитие, в ходе которого из простого возникает все более сложное, "представляет собой в своей сущности процесс интеграции рассеянной информации" [69].
Двоичная (бинарная) компартментализация реципрокных функций является качественной специфичностью биологической формы материи и индуцирует цикличность в реализации естественных биоритмов и жизнедеятельности организмов на всех уровнях биологической интеграции. Цепь передачи возбуждения от энтропийных локусов к антиэнтропийным с накоплением качественно новой биологической информации является основанием для утверждения безграничности эволюционного процесса с неуклонным увеличением жизненной Информации во Времени и Пространстве.
Данные о цикличности окислительно-восстановительных процессов и уровня АОА в делящихся клетках подтверждают участие этих процессов в регуляции митотического цикла.
Тогда самоорганизованная биосистема осуществляет во времени и пространстве определенную программу реализации динамического равновесия ассиметрично ориентированных функций - энтропийных и информационных (антиэнтропийных), обуславливая прямую и обратную связь между ними.
В пространстве признаков, содержащем лишь два класса объектов – живые и неживые – принципиальным может быть только одно различие между ними, а все остальные отличия должны вытекать из этого принципиального различия как следствия [89].
Внутренним фактором саморазвития, эволюции, источником самодвижения служит противоречие, заложенное в самой структуре биомолекул с компартментализацией энтропийных и антиэнтропийных локусов, выполняющих реципрокные функции - «Противоречие есть корень всякого движения и жизненности» [90, с.402].
Противоположно ориентированные в пространстве функции и динамически сбалансированные взаимоотношения энтропийных и антиэнтропийных, окислительных и антиокислительных, деструктивных и восстановительных процессов, реализуемые во времени в своём континууме - Пространстве, может лежать в основе развития эволюции живой материи. Цепь передачи возбуждения от энтропийных локусов к антиэнтропийным с накоплением качественно новой биологической информации является основанием для утверждения безграничности эволюционного процесса с неуклонным увеличением жизненной Информации и Энтропии во Времени и Пространстве.
ВЫВОДЫ
1. Показано, что интенсивность ЭПР-сигнала парамагнитных ионов комплексов марганца может служить индикатором свободно-радикальных, т.е. энтропийных процессов, а концентрация липорастворимых антиоксидантов – антиэнтропийных, т.е. информационных процессов.
2. Обнаружено динамическое равновесие и реципрокное соотношение между кинетиками СР и АО-процессов в листовой ткани хлопчатника при воздействии возбудителя вертициллезного вилта, особенно в первые дни после заражения. Показано, что радикалы – неотъемлемая часть жизненных процессов. «Бороться» с радикалами, как это часто встречается в медицинских и рекламных сайтах, значит действовать против жизни.
3. Для растений иммунных сортов хлопчатника в норме обнаружена более высокая по сравнению с восприимчивым сортом интенсивность содержания и радикалов, и антиоксидантов, что свидетельствует о структурной компартментализации соответствующих функций в мембранах и клетках растений
4. Показано, что подвижное равновесие парамагнитных и диамагнитных форм комплексов марганца чутко реагирует на баланс окислительных и антиокислительных процессов в живых фотосинтезирующих листьях растений. Поэтому концентрация парамагнитных комплексов ионов Мn+2 в зелёных листьях растений может служить сигналом, характеризующим интенсивность окислительных и радикальных, т.е. энтропийных процессов и выполняет роль сигнализатора – Redox-signaling.
5. Адаптивные процессы инициируются реакцией сверхчувствительности (у иммунных растений) всплеском энтропийного сигнала с последующей активацией антиэнтропийных процессов. Патологические процессы (у восприимчивого сорта) имеют место при контактном взаимодействии патогена с потенциально ослабленными, нечувствительными мембранными структурами растения-хозяина, в результате которого наблюдается снижение естественного уровня СР с последующим спадом АОА и жизнеспособности.
6. Характер ответа растения-хозяина на воздействие патогена определяется реактивностью мембранных структур растений, их способностью распознавать патоген как "хаотропный" агент.
7. Показана возможность повышения устойчивости растений путем усиления реактивности мембранных структур дозированными воздействиями про- и антиоксидантов на определенной фазе сниженной активности СР и АО для индуцирования адаптивных перестроек в растениях.
8. Результаты кинетических исследований системы хозяин-паразит на примерах взаимодействия растений хлопчатника различной устойчивости с грибом вилта различной вирулентности позволили автору сделать кардинальные выводы не только о детерминантной фазе патологических и адаптивных процессов в фитоиммунологии, но и о природе живых систем в целом
ЗАКЛЮЧЕНИЕ
Прежде основными факторами эволюции рассматривались наследственность и изменчивость. Механизмы реализации – мутации и естественный отбор [1]. Из кинетических исследований взаимодействия партнёров экосистемы «растение-хозяин - паразит» разработан новый подход к основам жизненных процессов. Прежде всего, постулировано наличие динамического равновесия энтропийных и информационных процессов в живых системах. Оно может существовать только в условиях структурной компартментализации реципрокных функций клеток и мембран. Неотъемлемым свойством и критерием жизненности является реактивность. Количественные параметры устойчивости, реактивности и надёжности жизнеобеспечения рассчитываются из кинетических данных изменения индикаторного параметра живой системы в результате дозированного неспецифического хаотропного воздействия.
Таким образом, физико-химическими критериями надёжности служат устойчивость и реактивность, а критериями изменчивости – лабильность (неустойчивость) и реактивность. В 2-хкомпартментальной модели биосистем энтропийные и антиэнтропийные (информационные) процессы распределены по компартментам реактивности и устойчивости. В зависимости от скоростей процессов, исходного пула (потенциала) устойчивости и реактивности системы относят к надёжным или изменчивым, лабильным. Тогда факторами биологической эволюции являются надёжность высших организмов и изменчивость низших.
Принцип самоорганизации материи основан на кооперировании элементов в систему, в которой свойства ее в целом будут отличны от суммы свойств ее элементов. Целостность биологической системы основана на взаимодействии и взаимовлиянии её энтропийных и антиэнтропийных, информационных компартментов, свойства которой фундаментально отличаются от свойств составляющих частей.
====================================================================
Материалы и методы:
Объектом исследования служили различающиеся по вилтоустойчивости сорта хлопчатника вида Gossipium hirsutum, (Кзыл-Рават, С-4727, С-2607, 108-Ф, 175-Ф, Л-340, а также высокоустойчивая разновидность дикого мексиканского хлопчатника Gossipium hirsutum ssp. mexicanum var. nervosum (образец № 06422 по каталогу ВНИИССХ им.Г.С.Зайцева МСХ СССР). Растения выращивали в сосудах Вагнера ёмкостью 30 кг в смеси почвы и песка /3:1/ в условиях теплицы и на вегетационной площадке. Подкормку минеральными удобрениями проводили по общепринятой методике.
Световой режим создавали выращиванием растений при естественном, короткодневном /свет - 10 час./ и круглосуточном освещении. Для круглосуточного освещения применяли лампы накаливания мощностью 300 вт, освещенность - 5300 лк.
Для искусственного заражения растений использовали две физиологические расы гриба Verticillium dahliae Klebahn, различающиеся по вирулентности: расу 1 (Янгиюльский штамм), поражающую старые промышленные сорта/108-Ф, С-4727/, и расу II, вирулентную к сортам с геном устойчивости, унаследованным от дикой разновидности nervosum /сорта типа "Ташкент"/. Культуру обеих рас выращивали в термостате при t = 24-26°С для расы I и 27-29°С для расы II на твердой среде Чапека и хранили в виде пробирочных культур на косом агаре при t = 4-100С. Инокулюм готовили путем смыва стерильной дистиллированной водой конидий с 10-12-дневной пробирочной культуры гриба, фильтрованием через ватный фильтр и разбавлением, после подсчета количества спор в камере Горяева, до требуемой концентрации. Для инокуляции использовали главным образом концентрацию спор, равной 3 млн спор на мл, а при решении отдельных вопросов использовали меньшую концентрацию - 0,5 млн.спор на мл. Заражение опытных растений хлопчатника проводили в фазе бутонизации (2-х месячного возраста) путем тройной инокуляции суспензии спор гриба шприцем в сквозные отверстия в стеблях, образованные шилом в зоне корневой шейки. Зараженность опытных растений проверяли после взятия образцов по наличию ярко-зеленой флуоресценции в продольных срезах главных стеблей хлопчатника. В контрольные растения инъецировали дистиллированную воду.
Образцы контрольных и опытных растений отбирали с учетом циркадной ритмичности в 11—12 ч ежедневно в течение недели и затем на 8, 12 , 20 и 28-й день после заражения.
Для изучения кинетики свободнорадикальных окислительных процессов в листьях хлопчатника использовали высокочувствительный метод спектроскопии электронного парамагнитного резонанса /ЭПР/. Предварительными опытами по изучению содержания парамагнитных центров была выявлена наименьшая вариабельность уровня радикалов для контрольных образцов листьев, взятых со среднего яруса. Листья верхнего яруса, где интенсивно протекают ростовые процессы, и листья нижнего яруса, в которых в фазе бутонизации начинаются процессы старения, показали менее воспроизводимые результаты.Ранее было показано, что уровень радикалов зависит также от освещенности и от фотопериодических условий [5]. Поэтому мы остановились на листьях среднего яруса одного узла с выравненной освещенностью и, соответственно, одинаковым влиянием факторов внешней среды.
Изучение динамики изменения интенсивности сигналов свободных радикалов /СР/ и парамагнитных комплексов /ПК/ Мn+2 в течение дневного периода показало, что максимум интенсивности, свидетельствующий об активизации окислительных процессов, наблюдался в 11-12 час.утра. Исходя из этих данных, для строгой стандартизации и сравнимости полученных результатов, образцы листьев фиксировали в жидком азоте в этом интервале времени. Из предварительно намеченных листьев контрольных и опытных растений вырезали стандартным пробочным сверлом диаметром 12 мм диски стандартной массы (28,8 ±0,5 мг), сворачивали в трубочку, помещали в запаянные с одного конца кварцевые капилляры диаметром 5 мм и открытым концом вниз немедленно опускали в дьюар с жидким азотом.
Спектры ЭПР регистрировали на радиоспектрометре E-4 “Varian” с термостатированием при 183oК в строго стандартизованных условиях мощности клистрона и постоянства поля радиоспектрометра. Оптимальная мощность СВЧ-энергии для сигналов СР с g-фактором 2,00 составляла 0,5 мвт, а для сигналов ПК Мn+2 c g-фактором 1,865-2,157 - 10 мвт, амплитуда ВЧ-модуляции поля 5 э, частота 9,15 Ггц, ширина развертки поля - 500 и 1000 э. Интенсивность сигналов ЭПР определяли по стандарту «Weack pitch», Сигнал ЭПР замороженных образцов в этом случае отражает состояние в исследуемой системе на момент взятия пробы. Повторность опытов трехкратная.
Поскольку полуширина сигналов СР и ПК Мn+2 во всех образцах оставалась постоянной, концентрацию СР и ПК Мn+2 определяли измерением амплитуды сигнала СР и первой, самой интенсивной компоненты ПК Мn+2.. Концентрацию парамагнитных ионов марганца измеряли по высоте амплитуды низкопольной компоненты сигнала Мn+2 (g =2,157). Результаты выражали в относительных единицах по сравнению с эталонным сигналом стабильного радикала ДФПГ.
Запаянный верхний конец капилляра предотвращал намораживание триплетного кислорода в образцах и уширение сигналов в спектрах ЭПР. Поскольку полуширина сигнала Мп+2 была постоянна для всех образцов, концентрацию парамагнитных комплексов марганца измеряли по высоте амплитуды низкопольной компоненты сигнала Мn+2 (g =2,157). Результаты выражали в относительных единицах по сравнению с эталонным сигналом стабильного радикала ДФПГ. Сигнал ЭПР замороженных образцов в этом случае отражает состояние в исследуемой системе на момент взятия пробы. Повторность опытов трехкратная.
Одновременно отбирали листья контрольных и опытных растений того же яруса и замораживали в пакетиках в жидком азоте для определения АОА (≈5 г).
Для определения антиокислительной активности /АОА/ использовали модель термического окисления метилового эфира олеиновой кислоты /Бурлакова, 1975/. Метилолеат (С19Н36О2), мол. масса = 286, t кип,= 212-213°С /15 мм рт.ст., 160-62°С /2-3 мм рт.ст., D = 0,879), очищали вакуумной перегонкой при t = 172°С / 3 мм рт.ст. Растворы липид-пигментного комплекса (ЛПК) в метилолеате, выделенного из зафиксированных в жидком азоте контрольных и опытных образцов листьев хлопчатника, хранили при t = - 5 -10°С – в дьюаре с твёрдым CO2.
Исследуемые образцы ЛПК разбавляли в очищенном метилолеате до концентрации 10-15 мг/мл, окисляли в термостатируемой ячейке (t = 80 ± 0,50 С) с барботируемым током кислорода (V ≥ 5 л/час.), обеспечивающим кинетическую область окисления. За ходом окисления следили по накоплению гидроперекисей в образцах, концентрацию которых определяли йодометрическим титрованием. Для каждого образца определяли период индукции — время, в течение которого концентрация гидроперекисей станет выше 0,1 ммоль/г.
Величину АОА определяли по формуле:
АОА = Dτ / c = (τ1 - τ0)/ c ,
где τ0 - период индукции при окислении чистого метилолеата, час.,
τ1 - период индукции метилолеата с ЛПК, час., с - концентрация ЛПК в метилолеате, г/мл.
За величину периода индукции принимали время, в течение которого концентрация гидроперекисей станет выше 0,1 ммоль/г.
Так как в состав ЛПК зелёных листьев хлопчатника входили и пигменты хлорофилла, то время τ – накопления гидроперекисей совпадало со временем обесцвечивания образца, что значительно облегчало фиксацию τ. Величину периода индукции можно определять также и по синхронному обесцвечиванию хлорофилла ЛПК. Для этого отвешенное количество окисляющегося субстрата (200 мг) растворяли в свежеперегнанном ацетоне (З мл) и спектрофотометриро-вали при длине волны λ = 660 нм. Достижение оптической плотности ацетоновых растворов D = 0,15 оказалось идентично накоплению гидроперекисей c концентрацией 0,1 ммоль/г.
Благодаря разработанной стандартизации условий взятия - с нивелированием посттравматических сигналов и учётом циркадной ритмичности биохимических параметров, ускоренной фиксации образцов растений в жидком азоте (5-10 сек) и регистрации спектров ЭПР образцов в оптимальном температурном режиме (t= -100±10С), были получены «моментальные снимки» интенсивности СР и АО процессов для исследуемых образцов растений хлопчатника в динамике инфицирования патогеном.
======================================================================
Список использованной литературы:
1. Яблоков А.В., Юсуфов А.Г. Эволюционное учение. М. Высшая школа, 2004, 310 с.
2. Воронцов Н.Н. Развитие эволюционных идей в биологии. М., 2001. С.604
3. Проворов Н.А. Растительно-микробные симбиозы как эволюционный континуум. ЖУРНАЛ ОБЩЕЙ БИОЛОГИИ. Том 70, 2009. № 1, январь-февраль. Стр. 10-34
4. Марков А.В. Симбиоз является более мощным двигателем эволюции.
5. Марков А. В. От биохимического сотрудничества – к общему геному.
6. Савинов А.Б. АУТОЦЕНОЗ И ДЕМОЦЕНОЗ КАК СИМБИОТИЧЕСКИЕ СИСТЕМЫ И БИОЛОГИЧЕСКИЕ КАТЕГОРИИ. ЖУРНАЛ ОБЩЕЙ БИОЛОГИИ, 2012, том 73, № 4, с. 284–301
7. Рустамова Ф.Н., Абдувахабов А.А., Сагдуллаев Х.Х. К ВОПРОСУ О КРИТЕРИЯХ НАДЁЖНОСТИ И ФАКТОРАХ КОЭВОЛЮЦИИ ПАРТНЁРОВ ДИНАМИЧЕСКОЙ СИСТЕМЫ РАСТЕНИЕ-ХОЗЯИН – ПАРАЗИТ, в кн. Структура и функции физиологически активных соединений, Ташкент, Изд-во «ФАН» Узбекской ССР, 1990, с.154-180 http://scorcher.ru/theory_publisher/show_art.php?id=645
8. http://slovari.yandex.ru/~книги/БСЭ/Радикалы свободные
9. Ben Best - Mechanisms of Aging
10. Владимиров Ю.А. Свободные радикалы в биологических системах. СОЖ, т.6, №12, 2000, с.13-19 ,
11. Семёнов Н.Н. ЦЕПНЫЕ РЕАКЦИИ. Госхимтехиздат 1934, Ленинградское отделение, 555 с
12. Каличава Г.С., Ванин А.Ф. Исследование методом ЭПР здоровых и пораженных ВТМ листьев табака. «Сообщения АН ГрузССР», 1971, № 3, т. 63, с.717-720.
13. Эмануэль Н. М., Липсиц Д. В., Круглякова К. В., Долягин А.Б., Симонян Г. Г. Роль свободных радикалов в ракоустойчивости картофеля.— Тез. XII Междунар.бот. конгресса, 1975, II, с. 503
14. Коваленко О.А., Иванникова А.Г., Чибрикин В.М., Пирузян Л.А. Биоритмы. II. Нарушение циркадных ритмов концентрации парамагнитных центров в органах мышей под действием рентгеновского облучения.— Биофизика, 1974, т. 19, вып. 4, с. 714.
15. Сагдуллаев Х.Х., Пирназарова Ф.Н., Исмаилов А.И.. Исследование динамики изменений концентрации парамагнитных центров листьев хлопчатника в норме и при вертициллеэном увядании. Всесоюзный симпозиум "Магнитный резонанс в биологии и медицине", Тез.докл., Москва, 1977, с.113-114.
16. Пирназарова Ф.Н., Сагдуллаев Х.Х., Тыщенко А.А., Степаниченко Н.Н. Изучение парамагнитных центров в хлоропластах и в листовой ткани хлопчатника. Всесоюзный симпозиум "Магнитный резонанс в биологии и медицине". Тез.докл., Москва, 1977, с.114-115.
17. Сагдуллаев Х.Х.Роль свободнорадикальных окислительных процессов в вилтоустойчивости хлопчатника. Автореф. дисс.канд.биол.наук. Ташкент, 1983. 22 с.
18. Пирназарова Ф.Н., Сагдуллаев Х.Х., Исмаилов А.И., Тыщенко А.А., Садыков А.С. Исследование свободнорадикальных состояний листьев хлопчатника при поражении вертициллезным вилтом. Доклады АН Уз.ССР, 1978, №2, с.46-49.
19. Тихонов А.Н., 1997. ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС В БИОЛОГИИ.
20. Пирназарова Ф.Н., Х.Х.Сагдуллаев, А.И.Исмаилов, А.А.Абраров. Исследование кинетики свободнорадикальных состояний в различных по вилтоустойчивости растениях хлопчатника. Физиология и биохимия культурных растений, 1978, №5, с.541-545=26
21. Пирназарова Ф.Н., Сагдуллаев Х.Х., Исмаилов А.И., Салахутдинов Б.А., Садыков А.С.. Окислительные и антиокислительные процессы в динамике взаимоотношений растение-хозяин - патоген. Физиология растений, 198З, №1, с.108-114
22.
23.
24. Жизнь на Земле держится всего на четырёх атомах марганца []
25. Чирков Ю. Г. Сумма жизни (Горизонты познания) - М.: Дет.лит., 1987, 143 с.
26. Рахимов Р.Х. Керамические материалы и их применение.Часть II. Ташкент, 2003, 657 c.
27. Jacob S. Kanady, Emily Y. Tsui, Michael W. Day, Theodor Agapie* A Synthetic Model of the Mn3Ca Subsite of the Oxygen-Evolving Complex in Photosystem II. Science 5 August 2011: Vol. 333 no. 6043 pp. 733-736
28. http://en.wikipedia.org/wiki/Oxygen_evolution
29. http://en.wikipedia.org/wiki/Photosynthesis,
30. http://en.wikipedia.org/wiki/Photosystem_II
31.
32. http://en.wikipedia.org/wiki/Redox_signaling
33. Сагдуллаев X.X., Пирназарова Ф.Н., Саидова М.А., Исмаилов А.И.,Садыков А.С. Исследование динамики изменения антиокислительной активности липидпигментного комплекса листьев хлопчатника различной вилтоустойчивости при заражении вилтом.— Докл. АН УзССР, 1980, № 10, с. 32-34.
34. Владимиров Ю. А., Арчаков А. И. Перекисное окисление липидов в биологических
мембранах. М.: Наука, 1972. 252 с.
35. Бурлакова Е. Б., Алесенко А. В., Молочкина Е. М., Пальмина Н. П., Храпова Н. Г.
Биоантиоксиданты в лучевом поражении и злокачественном росте. М. Наука, 1975, 214 с
36. Бурлакова Е. Б., Дзюба Н. М,, Пальмина Н. П. Действие ингибиторов свободно-радикальных реакций на антиокислительную активность липидов печени мышей при лучевой болезни и в перевивном лейкозе.— В кн.: Свободнорадикальные процессы в биологических системах. М.: Наука, 1966, с. 202.
37. Тарусов Б.Н. Устойчивость – надежность биологических систем при экстремальных воздействиях // Надежность клеток и тканей. Киев: Наукова думка, 1980. С. 16-18.
38. Тухтаева Г.М., Павловская Н.Е., Ходжаева А.С. Дыхание и фотосинтез хлопчатника, инфицированного грибом Verticcillium dahliae Kleb..— Узб. биол. ж., 1972, № 4, с. 16.
39. Архипова Г.В., Бурлакова Е.Б. Нарушение механизма выхода и переноса липидов биомембран при лучевом поражении и действии радиопротекторов.— В кн.: Некоторые теоретические аспекты противолучевой химической защиты. М.: Наука, 1980, с. 65.
40. Авазходжаев М.Х. Физиологические основы вилтоустойчивости хлопчатника и пути ее индуцирования. Автореф. дис. на соиск. учен. степени докт. биол. наук. Баку, 1984, 38с.
41. Пирназарова Ф.Н., Сагдуллаев Х.Х., Исмаилов А.И., Садыков А.С.. СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ ХЛОПЧАТНИКА К ВИЛТУ. Авт. св-во № 729873 (Т) от 26.12.1979.
42. Пирназарова Ф.Н., Сагдуллаев X. X., Гимашева Н.Ф., Исмаилов А.И., Садыков А.С. СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ К ФИТОПАТОГЕННЫМ ПОРАЖЕНИЯМ. Авт. св-во СССР № 728783. — Опубл. в Б.И., № 15, от 25.04.1980
43. Рустамова Ф.Н., Сагдуллаев Х.Х., Исмаилов А.И. СПОСОБ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ РАСТЕНИЙ ХЛОПЧАТНИКА К ФАКТОРУ ВНЕШНЕЙ СРЕДЫ. Авт. св-во СССР № 1507254. Опубл. в Б.И. №34, от 15.09.1989.
44. Таирбеков М.Г. Структурные и функциональные аспекты устойчивости растительной клетки // Усп. совр. биол. 1973. Т.75. № 3. С. 406-419.
45. Bell A.A., Stipanovic R.D. Biochemistry of disease and pest resistance in cotton // Mycopathologia. 1978. Vol.65. N 1-3. P. 91-106.
46. Деверолл Б.Дж. Защитные механизмы растений. М.: Колос, 1980. 128 с.
47. Фридович И. Радикалы кислорода, пероксид водорода и токсичность кислорода // Свободные радикалы в биологии. М.: Мир, 1979. С. 272-291.
48. Сагдуллаев X.X., Пирназарова Ф.Н., Исмаилов А.И., Садыков А.С. Реактивность мембранных структур как фактор надежности защитных систем клетки. — Докл. АН УзССР, 1982, № 4, с. 45.
49. Пирназарова Ф.Н., Сагдуллаев Х.Х., Исмаилов А.И., Садыков А.С. Антиокислительная активность для оценки надежности фитоиммунитета / Тезисы Всес. совещ. “Биоантиоксидант”. Москва-Черноголовка, 1983. С. 177-178.
50. Рустамова Ф.Н., Сагдуллаев Х.Х., Исмаилов А.И., Садыков А.С. Водорастворимые антиоксиданты в оценке реактивности и устойчивости сортообразцов хлопчатника. II Всес. конф. «Биоантиоксидант», Москва-Черноголовка, 1986. Тез.докл., т.2, с.152.
51. Саттаров Д.С., Рустамова Ф.Н., Сагдуллаев Х.Х., Нурмухамедова М.Д. СПОСОБ ОПРЕДЕЛЕНИЯ НАДЁЖНОСТИ ИММУНИТЕТА РАСТЕНИЙ. Авт. св-во СССР № 1706460 Опубл. в Б.И., №3, 23.01.1992.
52. Рустамова Ф.Н., Саттаров Д.С. К вопросу о роли окислительных и антиокислительных процессов в повышении надежности функционирования растительных систем. III Всес. конф. "Биоантиоксидант", Тез.докл., т.I, с.175. Москва, 1989.
53. Саттаров Д.С., Рустамова Ф.Н., Х.Х.Сагдуллаев. Критерии надежности иммунитета растений. Тезисы V Международ. симпозиума.по вертициллиуму. Ленинград, 1990, стр.77.
54. Саттаров Д.С., Рустамова Ф.Н., Сагдуллаев Х.Х. СПОСОБ ОПРЕДЕЛЕНИЯ НАДЕЖНОСТИ ЖИЗНЕОБЕСПЕЧЕНИЯ РАСТЕНИЙ. Авт.св-во СССР № 1205796. Опубл. в Б.И., №22, 15.06.1992.
55. Саттаров Д.С., Рустамова Ф.Н., Нурмухамедова М.Д. Жизнеспособность, устойчивость и реактивность – структурный и функциональные критерии надёжности жизнеобеспечения и иммунитета растений. Всесоюзн. конф. «Проблемы устойчивости биосистем», Москва, 1991. Тез.докл. с. 92.
56. Узбекова Д.У., Рустамова Ф.Н., Сагдуллаев Х.Х., Сысина Е.И., Ананченков В.И., Штефан В.Н., Рахимов Х.Р., Боева В.Н., Руденко Л.С. СПОСОБ ОПРЕДЕЛЕНИЯ ТРУДНО-ВСХОДИМЫХ СЕМЯН ХЛОПЧАТНИКА. Авт. св-во СССР № 1653571. Опубл. в Б.И. №21, от 07.06.1991.
57. Маргелис Л. Роль симбиоза в эволюции клетки. М.: Мир, 1984, 351 с.
58. Вавилов Н.И. Законы естественного иммунитета растений к инфекционным заболеваниям // Изв. АН СССР, Сер.биол. 1961. №1. С.117-156.
59. Bell A.A., Stipanovic R.D. Biochemistry of disease and pest resistance in cotton // Mycopathologia. 1978. Vol.65. N 1-3. P. 91-106.
60. Людвиг Больцман: биография
61. история компьютера –
62. Бриллюэн Л. Научная неопределенность и информация. М., «Мир», 1966
63. http://ru.wikipedia.org/wiki/Негэнтропия
64. Корогодин В.И., Корогодина В. Л. Информация как основа жизни – Дубна: Издательский центр «Феникс», 2000. – 208 с.
65. Кузнецова М. Энтропийный парадокс
66. Prigogine I. The philosophy of instability. - "Futures", 1989, р. 396—400. Prigozhin I. Filosofiya nestabilnosti, Voprosi filosofii, 1991, № 6, p. 46-52.
67. Алимходжаева Л.Т., Кадырова З.Ш., Тагирова Д.И., Сафина И.Н., Ризаева Н.К Диагностическая значимость уровня онкофетальных белков в мониторинге лечения рака молочной железы, сб. «Организация медицинской помощи», МСО МЗ РУз, Ташкент, 2011, с.55-57
68. Рустамова Ф.Н., Саттаров Д.С. К вопросу о роли энтропийных и антиэнтропийных процессов в развитии жизнеспособности и надежности иммунитета растений. Тезисы V Международного симпозиума по вертициллиуму. Ленинград, 1990, с.75.
69. Пригожин Илья. ДЕТЕРМИНИЗМА НЕТ НИ В ОБЩЕСТВЕ, НИ В ПРИРОДЕ (2000)
70. http://en.wikipedia.org/wiki/Free-radical_theory
71. .. 2009. Т. 428. . С. 474-479.
72. Orchestrated Objective Reduction of Quantum Coherence in Brain Microtubules: The "Orch OR" Model for Consciousness.
73. Гудков Л.Л., Шумаев К.Б., Каленникова Е.И., Ванин А.Ф., Рууге Э.К. Антиоксидантное и прооксидантное действие доноров и метаболитов оксида азота // Биофизика. 2007. T.52, № 3. C.503-508
74. Пирназарова Ф.Н., Чибрикин В.М., Вихляев Ю.И., Александровский Ю.А. К вопросу о зависимостях между строением и действием психофармакологических препаратов. Вопросы психофармакологии, М., 1967, с.522-532
75. Пирназарова Ф.Н., Полтораков А.П., Эмануэль Н.М. Катион-радикалы психофармакологических препаратов ряда фенотиазина. Узб.хим.журнал, 1970, №5, с.62-65.
76. Пирназарова Ф.Н. Физико-химические свойства психотропных препаратов ряда фенотиазина и родственных трициклических структур. Автореф.дис. канд.хим.наук, Т., 1971, 24 с.
77. Полтораков А.П. Физико-химические свойства производных фенотиазина и их связь с фармакологическим действием. Автореф. канд.хим.наук. Москва, 1984.
78. Полтораков А.П.,Пирназарова Ф.Н., Бут П.Г., Пирузян Л.А., Чибрикин В.М., Вихляев Ю.И., Ульянова О.В. Потенциалы ионизации производных фенотиазина и их корреляция с фармакологическим действием. Изв.АН СССР. Сер.хим., 1973, №9, с.2106-2110.
79. Скулачев В.П. СТРАТЕГИИ ЭВОЛЮЦИИ И КИСЛОРОД.
80. Сущность творчества. http://scorcher.ru/theory_publisher/show_art.php?id=69
81. Руднева И.И. Эколого-физиологические особенности антиоксидантной системы рыб и процессов ПОЛ. Усп. современной биологии, т.123, №4, 2003, с.391
82. Радюкина Н.Л., Шашукова А. В., Шевякова Н.И., Кузнецов Вл. В. Участие пролина в системе антиоксидантной защиты у шалфея при действии NaCl и параквата. Физиология растений, Т.55, № 5, г.2008. С. 721-730
83. http://ru.wikipedia.org/wiki/Амфифильность
84. Доброборский Б.С. ТЕРМОДИНАМИКА БИОЛОГИЧЕСКИХ СИСТЕМ. 2006, С-Пб
85. Энгельгардт В.А. Проблема жизни в современном естествознании. М.1969, 284 с. Энгельгардт В.А. Познание явлений жизни, М., 1984.
86. Мирзоян Э.Н. ИНФОРМАЦИОННО-БИОГЕОХИМИЧЕСКАЯ КОНЦЕПЦИЯ ЖИЗНИ М.М. КАМШИЛОВА. ИЗВЕСТИЯ РАН, сер.биол., 2004, № 6, с. 761-767
87. Thomas Wong, System Theory and Our Mind. The 55th Annual Conference of the International Society for Systems Sciences. Workshop Abstracts. July 17, 2011. p.46. ,
88. Костина Г., Механик А. Общая судьба сложных соединений в нашей Вселенной. Журнал «Эксперт», №8, 2007. АКАДЕМИЧЕСКИЕ БЕСЕДЫ / 83-89,
89. БАРБАРАШ А.Н. ЧТО ЕСТЬ ИНФОРМАЦИЯ, ЧТО ЕСТЬ ЖИЗНЬ?
90. Пригожин И., Стенгерс И. ПОРЯДОК ИЗ ХАОСА. Новый диалог человека с природой. Пер. с англ. - М.: Прогресс, 1986. 432 с.
Ташкент, Республика Узбекистан,
июнь 2016
Список произведений >>
Список публикаций >>
Оценить статью можно после того, как в обсуждении будет хотя бы одно сообщение.
Тест: А не зомбируют ли меня? Тест: Определение веса ненаучности
| Обнаружен организм с крупнейшим геномом Новокаледонский вид вилочного папоротника Tmesipteris oblanceolata, произрастающий в Новой Каледонии, имеет геном размером 160,45 гигапары, что более чем в 50 раз превышает размер генома человека. | Тематическая статья: Формирование субъективного опыта в онтогенезе |
Рецензия: Работы А.Иваницкого, комментарии | Топик ТК: Свойства осознанного внимания и циклы |